
【题目】黄钠铁矾[NaaFeb(SO4)c(OH)d]具有沉淀颗粒大、沉淀速率快、容易过滤等特点.某研究小组先将某废水中Fe2+氧化为Fe3+ , 再加入Na2SO4使其生成黄钠铁矾而除去铁.为测定黄钠铁矾的组成,该小组进行了如下实验:
①称取12.125g样品,加盐酸完全溶解后,配成250.00mL溶液A.
②量取25.00mL溶液A,加入足量的KI,再用0.2500molL﹣1Na2S2O3溶液滴定生成的I2(反应原理为I2+2Na2S2O3=2NaI+Na2S4O6),消耗30.00mL Na2S2O3溶液至终点.
③另取50.00mL溶液A,加入足量BaCl2溶液充分反应后,过滤,将所得沉淀洗涤、干燥后,称得其质量为2.330g.
(1)NaaFeb(SO4)c(OH)d中a、b、c、d之间的代数关系式为 .
(2)通过计算确定黄钠铁矾的化学式(写出计算过程).
【答案】
(1)a+3b=2c+d
(2)解:由相关反应知:n(Fe3+)=2n(I2)=n(Na2S2O3)
250 mL溶液A中:
n(Fe3+)=n(Na2S2O3)=0.2500 molL﹣1×30.00 mL×10﹣3LmL﹣1×10=7.50×10﹣2 mol
n(SO42﹣)= ![]() ×5=5.00×10﹣2mol
×5=5.00×10﹣2mol
根据质量守恒有:
n(Na+)×23 gmol﹣1+n(OH﹣)×17 gmol﹣1
=12.125 g﹣7.50×10﹣2 mol×56 gmol﹣1﹣5.00×10﹣2 mol×96 gmol﹣1
根据电荷守恒有:
n(Na+)+7.50×10﹣2 mol×3=5.00×10﹣2 mol×2+n(OH﹣)
解得:
n(Na+)=0.025 mol
n(OH﹣)=0.150 mol
a:b:c:d=n(Na+):n(Fe3+):n(SO2﹣4):n(OH﹣)=1:3:2:6
黄钠铁矾的化学式为NaFe3(SO4)2(OH)6.
答:黄钠铁矾的化学式为NaFe3(SO4)2(OH)6
【解析】解:(1)由题给信息,将某废水中Fe2+氧化为Fe3+ , 再加入Na2SO4使其生成黄钠铁矾而除去,黄钠铁矾[NaaFeb(SO4)c(OH)d]中铁元素化合价为+3价,元素化合价代数和为0,a+3b﹣2c﹣d=0,得到a+3b=2c+d;所以答案是:a+3b=2c+d;


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.16O和18O原子的核外电子排布不相同
B.含有离子键的化合物一定是离子化合物
C.HF、HCl、HBr、HI的熔沸点逐渐升高
D.干冰和二氧化硅熔化时所克服微粒间的相互作用相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量比为 2:5的锌与稀HNO3反应,若硝酸被还原的产物为N2O,反应结束后锌无剩余,则反应中被还原的HNO3与未被还原的HNO3的物质的量比为
A. 1:4 B. 1:5 C. 2:3 D. 2:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验中需用2.0 mol·L1的Na2CO3溶液950 mL,配制时应选用容量瓶的规格和称取Na2CO3固体的质量分别为
A.950 mL;201.4 g B.1 000 mL;212.0 g
C.100 mL;21.2 g D.500 mL;100.7 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质互为同系物的是 ( )
A. C6H5OH和C6H5CH2OH B. CH3OH和HOCH2CH2OH
C. HCOOH和C17H35COOH D. CH3Cl和CH2Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项叙述中,正确的是( )
A.Ge的电负性为1.8,则其是典型的非金属
B.L层不含s能级,M层存在3f能级
C.焰火是焰色反应,都是电子由基态跃迁到激发态的结果
D.在电子云示意图中,小黑点是电子在原子核外出现的概率密度的形象描述
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断正确的是( )
A.同温、同压下,相同体积的氮气和氦气所含的原子数相等
B.标准状况下,5.6 L以任意比例混合的氯气和氧气所含的原子数为0.5NA
C.1 mol氯气和足量NaOH溶液反应转移的电子数为2NA
D.常温常压下,22.4 L的NO2和CO2混合气体含有2NA个O原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的成员捡到一块矿石,观察外观发现该矿石坚硬且呈红褐色,投入水中没有任何变化,再向水中加浓盐酸至过量,矿石部分溶解,并有大量无色气体生成.学生猜测该矿石可能由CaCO3、SiO2、Fe2O3三种成分组成,试设计实验证明CaCO3以外的两种成分. 仅限选择的仪器和试剂:烧杯、试管、玻璃棒、滴管、药匙、漏斗、漏斗架;2 molL﹣1盐酸、2molL﹣1NaOH溶液、2%的KSCN溶液.
(1)将实验方案用以下流程示意图表示,试写出每步所用试剂的名称或化学式. 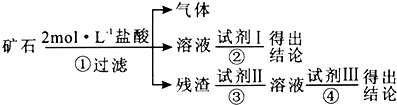
试剂Ⅰ;试剂Ⅱ;试剂Ⅲ .
(2)如果猜测是成立的,试根据上述实验方案,叙述实验操作,预期现象和结论.
编号 | 实验操作 | 预期现象和结论 |
① | 取适量矿石研细,加 | 有大量无色气体生成,得棕黄 |
② | ||
③ | ||
④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(工业上采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4 , 主要流程如图1: 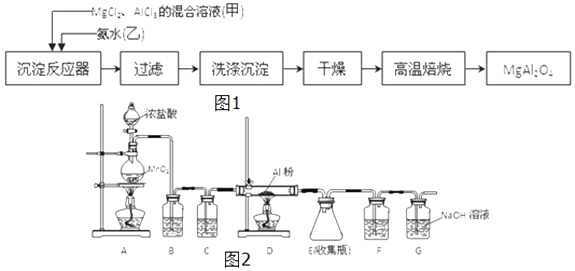
(1)写出沉淀反应器中生成氢氧化镁的离子方程式;
(2)判断流程中沉淀是否洗净的方法;高温焙烧时,用于盛放固体的仪器名称是;
(3)无水AlCl3遇潮湿空气即产生大量白雾而变质,实验室可用如图2下列装置制备. A中进行的化学方程式为;
装置B中的试剂是;F中试剂的作用是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com