
下列各项判断正确的是( )
A.AlN可通过反应Al2O3+N2+3C 2AlN+3CO合成。该反应中,每生成1 mol AlN需转移1.5 mol电子
2AlN+3CO合成。该反应中,每生成1 mol AlN需转移1.5 mol电子
B.CsICl2是一种碱金属的多卤化物,这类物质在化学反应中既可表现氧化性又可表现还原性,则在CsICl2溶液中通入Cl2,有单质碘生成
C.反应A+3B 2C+2D在四种不同情况下的反应速率分别为
2C+2D在四种不同情况下的反应速率分别为
①v(A)=0.15 mol/(L·s);②v(B)=0.6 mol/(L·s);
③v(C)=0.4 mol/(L·s);④v(D)=0.45 mol/(L·s)。
该反应进行的快慢顺序为④>③=②>①
D.AlCl3溶液中加入过量稀氨水,则反应的离子方程式为:
Al3++4NH3·H2O===AlO +4NH
+4NH +2H2O
+2H2O
 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
在可逆反应2SO2+O2 2SO3中,充入一定量的18O2,足够长的时间后,18O原子
2SO3中,充入一定量的18O2,足够长的时间后,18O原子
A.只存在于O2中 B.只存在于O2和SO3中
C. 只存在于O2和SO2中 D. 存在于O2、SO2和SO3中
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学设计了如下实验流程:在一个小烧杯里,加入20g Ba(OH)2·8H2O晶体和10gNH4Cl晶体,然后将小烧杯放在事先已滴有3滴~4滴水的玻璃片上,并立即用玻璃棒迅速搅拌。实验流程示意图如下,回答下列问题:

⑴ 实验中玻璃棒的作用是 。
⑵ 浸有稀硫酸的棉花的作用是 。
⑶ 通过 现象,说明该反应为 (填“吸热”或“放热”)反应,这是由于反应物的总能量 (填“小于”、 “大于” 或“等于”)生成物的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
以下关于化学实 验中“先与后”的说法中正确的是( )
验中“先与后”的说法中正确的是( )
①加热试管时,先均匀加热,后局部加热;
②用排水法收集气体时,先移出导管后撤酒精灯;
③制取物质时,先检查装置气密性后装药品;
④使用容量瓶、分液漏斗、滴定管前, 先检查是否漏水后洗涤干净;
先检查是否漏水后洗涤干净;
⑤做H2还原CuO实验时,先加热CuO后通H2;反应完毕后,先撤酒精灯待试管冷却后停止通H2。
A.除②以外 B.除④以外 C.除⑤以外 D.全部正确
查看答案和解析>>
科目:高中化学 来源: 题型:
用 nA表示阿伏加德罗常数的数值,下列说法正确的是( )
A.23gNO2和N2O4的混合气体中含有的氮原子数为0.5nA
B.4.2 g丙烯中所含的共价键数目为0.6nA
C.1 L 0.1 mol/L的Fe2(SO4)3溶液中,Fe3+的数 目为0.2 nA
目为0.2 nA
D.过氧化氢分解制得标准状况下1.12 L O2,转移电子数目为 0.2 nA
查看答案和解析>>
科目:高中化学 来源: 题型:
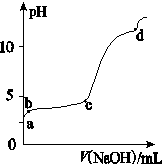 (Ⅰ) 室温下,在30ml的 Al2(SO4)3溶液中,逐滴加入1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示。
(Ⅰ) 室温下,在30ml的 Al2(SO4)3溶液中,逐滴加入1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示。
(1)写出a点溶液呈酸性的离子方程式:
(2)若c点时V(NaOH)为90ml,则Al2(SO4)3溶液的物质的量浓度约为:
(3)写出b~c段反应的离子方程式: ,
(4) d点时,V(NaOH)约为 

(Ⅱ)常温下有浓度均为0.5 mol/L的四种溶液:
①Na2CO3溶液 ②NaHCO3溶液 ③HCl溶液 ④氨水
(1) 向④中加入少量氯化铵固体,此时c(NH4+)/c(OH-)的值________(填“增大”、“减小”或“不变”)。
(2)若将③和④的溶液混合后溶液恰好呈中性则混合 前③的体积________④的体积(填“大于”、“小于”或“等于”),此时溶液中离子浓度由大到小的顺序是________________。
前③的体积________④的体积(填“大于”、“小于”或“等于”),此时溶液中离子浓度由大到小的顺序是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
(1)反应的ΔH________0(填“大于”或“小于”);100 ℃时,体系中各物质浓度随时间变化如图所示。在0~60 s时段,反应速率v(N2O4)为________mol·L-1·s-1;反应的平衡常数K1为________。
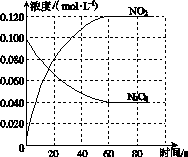
(2)100 ℃时达平衡后,改变反应温度为T,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
①T________100 ℃(填“大于”或“小于”),判断理由是____________________________。
②列式计算温度T时反应的平衡常数K2:_______________________________________
________________________________________________________________________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是__________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4,溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。 回答下列问题:

(1)外电路的电流方向是由________极流向________极。(填字母)
(2)电池正极反应式为__________________________。
(3)是否可用水代替电池中的混合有机溶剂?________(填“是”或“否”),原因是________________________________________________。
(4)MnO2可与KOH和KClO3在高温下反应,生成K2MnO4,反应的化学方程式为____________________________________。K2MnO4在酸性溶液中歧化,生成KMnO2和MnO2的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氢氟酸是一种弱酸,可用来刻蚀玻璃。已知25℃时
①HF(aq)+OH—(aq)=F—(aq)+H2O(l) △H=—67.7KJ·mol—1
②H+(aq)+OH—(aq)=H2O(l) △H=—57.3KJ·mol—1
在20mL0.1·molL—1氢氟酸中加入VmL0.1mol·L—1NaOH溶液,下列有关说法正确的是
A.氢氟酸的电离方程式及热效应可表示为:
HF(aq)=H+(aq) +F−(aq) △H=+10.4KJ·mol—1
B.当V=20时,溶液中:c(OH—)=c(HF) +c(H+)
C.当V=20时,溶液中:c(F—)<c(Na+)=0.1mol·L—1
D.当V >0时,溶液中一定存在:c(Na+)>c(F—)>c(OH—)>c(H+)
>0时,溶液中一定存在:c(Na+)>c(F—)>c(OH—)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com