
【题目】常温下,下列物质中原子数最多的是
A. 64 g SO2 B. 3.01×1023个N2
C. 0.75 mol H2S D. 36 mL H2O
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.灼烧至红热的细铁丝与氯气反应生成FeCl2
B.常温常压下,22.4L SO2中含有的分子数为6.02×1023
C.纯碱溶液呈碱性,热的纯碱溶液可以去除物品表面的油污
D.Na2O2能与水或CO2反应生成O2,可用作呼吸面具中的供氧剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的表示及说法正确的是
A. 已知![]()
![]() ,则氢气的燃烧热为-241.8kJ/mol
,则氢气的燃烧热为-241.8kJ/mol
B. ![]() 、101 kPa时,求算固态碳和硫的燃烧热时.其分别燃烧时生成稳定的
、101 kPa时,求算固态碳和硫的燃烧热时.其分别燃烧时生成稳定的![]() 和
和![]()
C. 含![]() 的稀溶液与稀硫酸完全中和,放出
的稀溶液与稀硫酸完全中和,放出![]() 的热量,则表示该反应的中和热的热化学方程式为:2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)
的热量,则表示该反应的中和热的热化学方程式为:2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) ![]()
D. 已知![]()
![]() ,
,![]()
![]() ,则
,则![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示。请针对以下三种不同情况回答:

(1)若A、B、C均为化合物且焰色反应均为黄色,水溶液均为碱性。则C物质的化学式是_____________。
(2)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。
①A中含有的金属元素为___________。(写元素符号)
②该金属元素的单质与某红棕色粉末在高温下反应,可用于焊接铁轨,反应的化学反应方程式为__________。
若A为固态非金属单质,A与X同周期,常温常压下C为白色固体,B分子中各原子最外层均为8e-结构。C与水剧烈反应,生成两种常见酸,反应的化学方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在3个容积均为![]() 的恒容密闭容器中反应
的恒容密闭容器中反应![]() 达到平衡,下列说法正确的是
达到平衡,下列说法正确的是
容器 | 温度 | 物质的起始浓度 | 物质的平衡浓度 | ||
|
|
|
| ||
Ⅰ | 400 |
|
| 0 |
|
Ⅱ | 400 |
|
| 0 |
|
Ⅲ | 500 |
|
| 0 |
|
A. 该反应的正反应是吸热反应
B. 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的小
C. 达到平衡时,容器Ⅱ中![]() 小于容器Ⅲ中
小于容器Ⅲ中![]()
D. 达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种工业制备SrCl2·6H2O的生产流程如下图所示:

已知:①M(SrCl2·6H2O)=267 g/mol;
②Ksp(SrSO4)=3.3×10-7、Ksp(BaSO4)=1.1×10-10;
③经盐酸浸取后,溶液中有Sr2+和Cl-及少量Ba2+。
(1)隔绝空气高温焙烧,若2 mol SrSO4中只有S被还原,转移了16 mol电子。写出该反应的化学方程式:______________________________ 。
(2)过滤2后还需进行的两步操作是_____、_____。
(3)加入硫酸溶液的目的是_____;为了提高原料的利用率,滤液中Sr2+的浓度应不高于_____ mol/L(注:此时滤液中Ba2+浓度为1×10-5 mol/L)。
(4)产品纯度检测:称取1.000 g产品溶解于适量水中,向其中加入含AgNO3 1.100×10-2 mol的AgNO3溶液(溶液中除Cl-外,不含其他与Ag+反应的离子),待Cl-完全沉淀后,用含Fe3+的溶液作指示剂,用0.2000 mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+ 以AgSCN白色沉淀的形式析出。
①滴定反应达到终点的现象是_____。
②若滴定过程用去上述浓度的NH4SCN溶液20.00 mL,则产品中SrCl2·6H2O的质量百分含量为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,A是由X和Y两种短周期元素组成的气体,X的原子序数小于Y,甲、乙、丙分别是X、Y、Z元素对应的单质,Z是地壳中含量最高的元素,它们有如右图所示的转化关系。下列说法不正确的是

A. X、Y、Z三种元素能组成离子化合物
B. 反应②为化合反应,反应③为置换反应
C. 常温常压下,Z的简单氢化物的熔沸点为同族最高
D. 原子半径:Y>Z>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)已知室温下CO的燃烧热为283 kJ/mo1,则CO的燃烧热的热化学方程式为___________________________________。
(2)工业上利用CO和H2合成清洁能源CH3OH,其反应为:CO(g)+2H2(g)![]() CH3OH(g) ΔH=-116kJ/mo1
CH3OH(g) ΔH=-116kJ/mo1
如图表示CO的平衡转化率(α)随温度和压强变化的示意图。X表示的是_____________,Y1_____Y2(填“<”、“=”、“>”)。
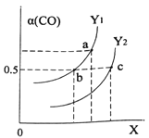
(3)合成甲醇的反应原理为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),在1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),在1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。

①反应进行到4min时,v(正)____v(逆)(填“>”“<”或“=”)。0~4min,CO2的平均反应速率v(CO2)=____________mol·L1·min1。
②该温度下平衡常数为_____________。
③下列能说明该反应已达到平衡状态的是______________。
A.v正(CH3OH)=3v逆(H2)
B.CO2、H2、CH3OH和H2O浓度之比为1∶3∶1∶1
C.恒温恒压下,气体的体积不再变化
D.恒温恒容下,气体的密度不再变化
(4)为提高燃料的能量利用率,常将其设计为燃料电池。某电池以甲烷为燃料,空气为氧化剂,KOH溶液为电解质溶液,以具有催化作用和导电性能的稀土金属为电极。写出该燃料电池的负极反应式:_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com