
 2Z(g)+aQ(g)����H =b kJ/mol���ﵽƽ��ʱ����0.8 mol Z�����Q��Ũ��Ϊ0.4 mol/L������������ȷ����
2Z(g)+aQ(g)����H =b kJ/mol���ﵽƽ��ʱ����0.8 mol Z�����Q��Ũ��Ϊ0.4 mol/L������������ȷ����| A��ƽ��ʱX��Y��ת������� |
| B��ƽ��ʱX��Ũ��Ϊ0.2 mol/L |
| C������ͬʵ�������£�����ͬһ�������и�Ϊ����2 mol Z��2 mol Q���ﵽ��ƽ��ʱZ���������Ϊ20% |
| D���������¶ȣ�Y���������������b��0 |
 2Z(g)+2Q(g)
2Z(g)+2Q(g)

 Сѧѧϰ�ð���ϵ�д�
Сѧѧϰ�ð���ϵ�д� Сѧͬ�����������ܾ�ϵ�д�
Сѧͬ�����������ܾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| ʵ���� | 1 | 2 | 3 | 4 | 5 |
| c(HI)/mol��L��1 | 0.100 | 0.200 | 0.300 | 0.100 | 0.100 |
| c(H2O2)/mol��L��1 | 0.100 | 0.100 | 0.100 | 0.200 | 0.300 |
| v/mol��L��1��s��1 | 0.007 60 | 0.015 3 | 0.022 7 | 0.015 1 | 0.022 8 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

| A��10sʱ���÷�Ӧ�Ѿ�ֹͣ |
| B��10s֮ǰX����������С�������������� |
| C��10sʱ����Ӧ���ʵ����淴Ӧ���� |
| D��10sʱX��Y��Z��Ũ�ȱ��ֲ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���ܹ���Լԭ�Ϻ���Դ | B���ܹ���߲�Ʒ�IJ��� |
| C���ܹ���߾���Ч�� | D���ܹ����ѧ��Ӧ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
 2NH3(g)
2NH3(g)�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��0.1 mol��L-1�������0.1 mol��L-1�Ĵ���ֱ���2 mol��L-1��NaOH��Ӧ��������ͬ |
| B����п��ϡ���ᷴӦ��ȡ����ʱ,������������ͭ��Һ��ʹ���������ķ�Ӧ�ӿ� |
| C��Mg�ۺ�Fe�۷ֱ���0.1 mol��L-1�����ᷴӦ������ͬ |
| D������ʯ�������ʯ�۷ֱ���0.1 mol��L-1�����ᷴӦ��������ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
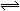 2SO��(g) ������Ӧ���ȣ����������жϸ÷�Ӧ�ﵽƽ��״̬�ı�־��
2SO��(g) ������Ӧ���ȣ����������жϸ÷�Ӧ�ﵽƽ��״̬�ı�־��| A�������л��������ܶȱ��ֲ��� | B��ÿ���ģ�molO2��ͬʱ���ɣ�molSO3 |
| C�������������ѹǿ���� | D��SO3������������SO2������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

 =" 9" mol/��L��min��
=" 9" mol/��L��min�� = 9mol/��L��min��
= 9mol/��L��min���鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com