
 2NH3(g)
2NH3(g) 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题
 2C(g)+2D(g)△H<0,反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
2C(g)+2D(g)△H<0,反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则: “不变”填空)。
“不变”填空)。| 编号 | 改变的条件 | 生成D的速率 |
| ① | 降低温度 | |
| ② | 增大A的浓度 | |
| ③ | 使用催化剂 | |
| ④ | 恒容下冲入Ne(不参与体系反应) | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3,
2NH3, 后测得N2的物质的量为0.6mol,则:
后测得N2的物质的量为0.6mol,则:查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| I | 2 mL | 20 | |
| II | 2 mL | 20 | 10滴饱和MnSO4溶液 |
| III | 2 mL | 30 | |
| IV | 1 mL | 20 | 1 mL蒸馏水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.食品放在冰箱中贮藏 |
| B.用铁粉代替铁钉与稀硫酸反应制取氢气 |
| C.合成氨工业中使用催化剂 |
| D.在试管中进行铝和盐酸反应时,稍微加热 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 C(g)+2D(g);ΔH<0,达到平衡后,为提高该反应的速率并使平衡向正反应方向移动,采取的正确措施是( )
C(g)+2D(g);ΔH<0,达到平衡后,为提高该反应的速率并使平衡向正反应方向移动,采取的正确措施是( )| A.加催化剂同时升高温度 | B.加催化剂同时增大压强 |
| C.升高温度同时充入A气体 | D.降低温度同时增大压强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2Z(g)+aQ(g);ΔH =b kJ/mol。达到平衡时生成0.8 mol Z,测得Q的浓度为0.4 mol/L,下列叙述正确的是
2Z(g)+aQ(g);ΔH =b kJ/mol。达到平衡时生成0.8 mol Z,测得Q的浓度为0.4 mol/L,下列叙述正确的是| A.平衡时X与Y的转化率相等 |
| B.平衡时X的浓度为0.2 mol/L |
| C.在相同实验条件下,若在同一个容器中改为加入2 mol Z和2 mol Q,达到新平衡时Z的体积分数为20% |
| D.若升高温度,Y的体积分数增大,则b<0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
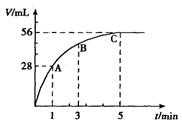
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com