
【题目】如图所示,左室容积为右室的两倍,温度相同,现分别按照如图所示的量充入气体,同时加入少量固体催化剂使两室内气体充分反应达到平衡,打开活塞,继续反应再次达到平衡,下列说法不正确的是( )
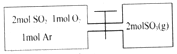
A. 第一次平衡时,SO2的物质的量左室更多
B. 入气体未反应前,左室压强和右室样大
C. 第一次平衡时,左室内压强一定小于右室
D. 第二次平衡时,SO2的总物质的量比第一次平衡时左室SO2的物质的量的2倍还要多
【答案】D
【解析】由于为恒容容器,1molAr对化学平衡无影响,容器中发生的反应为2SO2(g)+O2(g)![]() 2SO3(g)。A项,若右室的容积与左室相等,左室和右室在相同条件达到的平衡状态相同,含有的SO2物质的量相等,右室在此平衡时将体积缩小为1/2,增大压强,平衡向正反应方向移动,SO2物质的量减少,第一次平衡时,SO2物质的量左室更多,A项正确;B项,通入气体未反应前,左室气体总物质的量为2mol+1mol+1mol=4mol,右室气体总物质的量为2mol,左室容积为右室的两倍,温度相同,则左室压强和右室一样大,B项正确;C项,左室从正反应开始建立平衡,左室平衡时压强小于左室起始压强,右室从逆反应开始建立平衡,右室平衡时压强大于右室起始时压强,左室与右室起始压强相等,则第一次平衡时左室内压强一定小于右室,C项正确;D,若在容积为2倍左室容积的容器中起始充入4molSO2、2molO2,相同条件下达到平衡时SO2物质的量为左室SO2物质的量的2倍,打开活塞相当于容积为1.5倍左室容积的容器中起始充入2molSO2、1molO2、2molSO3(g)、1molAr,等效于容积为1.5倍左室容积的容器中起始充入4molSO2、2molO2、1molAr,相对于2倍左室容积的容器缩小体积,增大压强,平衡向正反应方向移动,SO2物质的量减小,即第二次平衡时,SO2的总物质的量比第一次平衡时左室SO2物质的量的2倍要少,D项错误;答案选D。
2SO3(g)。A项,若右室的容积与左室相等,左室和右室在相同条件达到的平衡状态相同,含有的SO2物质的量相等,右室在此平衡时将体积缩小为1/2,增大压强,平衡向正反应方向移动,SO2物质的量减少,第一次平衡时,SO2物质的量左室更多,A项正确;B项,通入气体未反应前,左室气体总物质的量为2mol+1mol+1mol=4mol,右室气体总物质的量为2mol,左室容积为右室的两倍,温度相同,则左室压强和右室一样大,B项正确;C项,左室从正反应开始建立平衡,左室平衡时压强小于左室起始压强,右室从逆反应开始建立平衡,右室平衡时压强大于右室起始时压强,左室与右室起始压强相等,则第一次平衡时左室内压强一定小于右室,C项正确;D,若在容积为2倍左室容积的容器中起始充入4molSO2、2molO2,相同条件下达到平衡时SO2物质的量为左室SO2物质的量的2倍,打开活塞相当于容积为1.5倍左室容积的容器中起始充入2molSO2、1molO2、2molSO3(g)、1molAr,等效于容积为1.5倍左室容积的容器中起始充入4molSO2、2molO2、1molAr,相对于2倍左室容积的容器缩小体积,增大压强,平衡向正反应方向移动,SO2物质的量减小,即第二次平衡时,SO2的总物质的量比第一次平衡时左室SO2物质的量的2倍要少,D项错误;答案选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】维尔纳配合物M是一种橙黄色单斜晶体。该晶体以浓氨水、双氧水、CoCl26H2O、NH4Cl 为原料在加热条件下通过活性炭的催化来合成。为探究该晶体的组成,设计了如下实验:
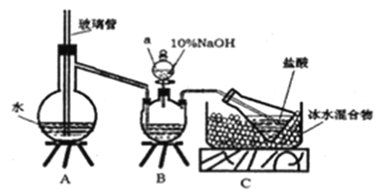
步骤一,氮的测定:准确称取一定量橙黄色晶体,加入适量水溶解,注入下图所示的三预瓶中,然后逐滴加入足量10%NaOH溶液,通入 水蒸气,将样品中的氨全部蒸出,用500.00mL7.0mol /L的盐酸溶液吸收,吸收结束后量取吸收液25.00mL,用2.00mol/L的NaOH溶液滴定过量的盐酸,终点消耗NaOH溶液12.50mL。
步骤二,氯的测定: 准确称取橙黄色晶体wg,配成溶液后用AgNO3标准溶液滴定,以K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色沉淀)。
(1)装置B中仪器a的名称为_______。
(2)裝置A、B 三脚架处应放置一个酒精灯作为热源,酒精灯应放置在___(填“A”或“B”) 处。
(3) 步骤一所称取的样品中含氮的质量为_______g。
(4)有同学提出装置C中所用盐酸的浓度过大易挥发,会造成测得氮的含量结果将____ (填“偏高”、“偏低”或“无影响”); 冰水混合物的作用是________。
(5) 测定氯的过程中,使用棕色滴定管的原因是_______; 出现浅红色沉淀时,若溶液中c(CrO42-)=0.0025mol/L,通过计算说明该实验可以使用K2CrO4溶液为指示剂的原因______ (呈现计算过程)。已知: Ksp(Ag2CrO4)=1.0×10-12 Kp(AgCl)=1.8×10-10
(6)经上述实验测定,配合物M中钻、氮、氯的物质的量之比为1: 6: 3,其中氮元素以氨的形式存在。制备M的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置制备二氧化氮气体,并探究相关产物性质。
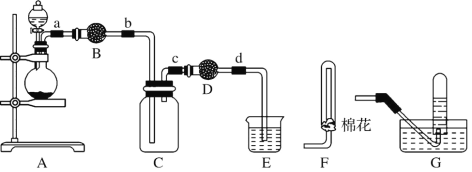
(1) 装置A中的分液漏斗盛装的液体是____,烧瓶中预先加入的是铜屑,铁的价格比铜的价格低,此处用铜不用铁的原因是______________。
(2) 干燥管B、D中盛装的干燥剂可以是____(填“浓硫酸”、“无水氯化钙”、“五氧化二磷”或“碱石灰”),干燥管D中干燥剂的作用是______________。
(3) 装置E的作用是吸收尾气,吸收过程中发生反应的化学方程式如下,请将其补充完整。
NaOH+ NO2![]() + NaNO2+ H2O ______
+ NaNO2+ H2O ______
(4) 某化学兴趣小组认为铜和适量浓硝酸反应产生的气体中含NO,选用下列必要的装置(N2和O2的用量可自由控制)完成验证实验。
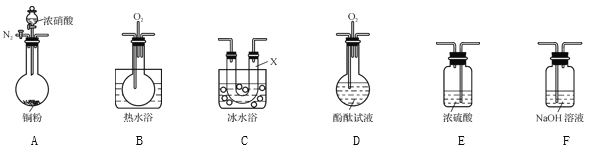
已知:
i. NO+NO2+2OH-![]() 2NO2-+H2O
2NO2-+H2O
ii气体液化温度如下:
气体 | NO2 | NO |
液化温度 | 21 ℃ | -152 ℃ |
①仪器的连接顺序(按从左→右连接,填各仪器字母)为________。
②实验时先检查装置气密性后,再加入试剂,在反应前的操作是_______。
③确认气体中含NO的现象是__________;装置C的作用是____。
④NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的气体中氮氧化物脱除技术。现在有NO、NO2的混合气6 L,可用同温同压下7 L NH3恰好使其完全转化为N2,则原混合气体中NO和NO2的物质的量之比为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体物质只含有钠和氧两种元素,将它放在足量的水中反应产生两种气体,这两种气体又可以在一定条件下反应生成水.则原固体物质的组成是( )
A.Na2O2与Na2O
B.Na2O2
C.Na2O2与Na
D.Na和Na2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A是石油裂解气的主要产物之一,其产量常用于衡量一个石油化工发展水平的标志。下列是有机物A~G之间的转化关系:

请回答下列问题:
(1)A的官能团的名称是____________。C的结构简式是____________。
(2)E是一种具有香味的液体,由B + D→的反应方程式为:____________。该反应类型是____________。
(3)G是一种高分子化合物,其名称是____________,链节是____________。
(4)比赛中,当运动员肌肉挫伤或扭伤时,随队医生即对准受伤部位喷射物质F(沸点12.27OC)进行应急处理。写出由A制F的化学反应方程式:____________。决定F能用于冷冻麻醉应急处理的性质是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2(约45%)、Fe2O3(约40%)、Al2O3 (约10%)和MgO(约5%)。其同学设计了如下方案,分离样品中各种金属元素。
已知: Fe(OH)3的Ksp=4.0×10-38。请回答下列问题。
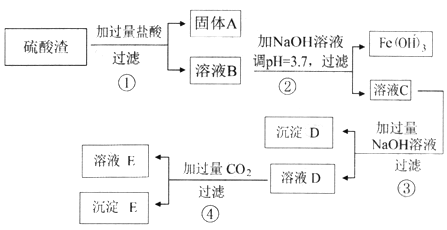
(1) 固体A的一种工业应用________;沉淀D的电子式___________。
(2) 溶液B中所含的金属阳离子有___________。(写离子符号)
(3) 若步骤②中调pH 为3.0,则溶液C中的Fe3+ 是否沉淀完全,通过计算说明______。
(4) 写出步骤④中全部反应的离子方程式_______________。
(5) 为了分析某硫酸渣中铁元素的含量,先将硫酸渣预处理,把铁元索还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定。
①判断到达滴定终点的现象是__________。
②某同学称取2.000g硫酸渣,预处理后在容量瓶中配制成100mL 溶液,移取25.00mL 试样溶液,用0.0050 mol/L KMnO4标准溶液滴定,达到滴定终点时,消耗标准溶液20.00mL,则残留物中铁元素的质量分数是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容密闭容器中,当下列物理量不再变化时,可表明反应:A(g)+B(g)![]() C(g)+D(g) 已达化学平衡状态的是( )
C(g)+D(g) 已达化学平衡状态的是( )
A. 混合气体的压强 B. B的物质的量浓度 C. 混合气体的密度 D. v(A)正 = v(D)正
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液、胶体和浊液三种分散系,其分散质的根本区别是
A.是否产生丁达尔效应B.分散质微粒直径的大小
C.是否均一、稳定、透明D.是否能透过滤纸、半透膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫醉钠又名”大苏打”,溶液具有弱碱性和较强的还原性,是棉织物漂白后的脱氯剂,定量分析中的还原剂.硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得,装置如图I所示.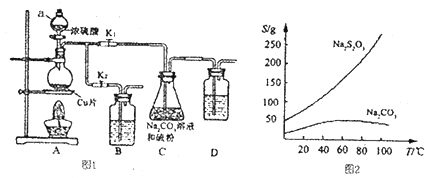
已知:Na2S2O3在酸性溶液中不能稳定存在,有关物质的溶解度曲线如图2所示.
(1)Na2S2O35H2O的制备:
步骤1:如图连接好装置后(未装药品),检查A、C装且气密性的操作是_ .
步骤2:加人药品,打开K1、关闭K2、加热.装置B、D中的药品可选用下列物质中的(填编号).
A.NaOH溶液 B.浓H2S04C.酸性KMnO4溶液 D.饱和NaHCO3溶液
步骤3:C中混合液被气流搅动,反应一段时间后,硫粉的最逐渐减少.
步骤4:过滤C中的混合液,将滤液经过加热浓缩,趁热过滤,再将滤液过滤、洗涤、烘干,得到产品.
(2)Na2S2O3性质的检验:向足量的新制氯水中滴加少量Na2S2O3溶液,氯水颜色变浅,检查反应后溶液中含有硫酸根,写出该反应的化学方程式 .
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00mL,控制适当的酸度加人足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解.此时Cr42﹣全部转化为Cr2O72﹣;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.010molL﹣1的Na2S2O3溶液进行滴定,反应完全时,消耗Na2S2O3溶液18.00mL.部分反应的离子方程式为:Cr2O72﹣+6I﹣+14H+═2Cr3++3I2+7H2O.I2+2S2O32﹣═S4O62﹣+2I﹣ , 则该废水中Ba2+的物质的量浓度为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com