
����Ŀ��ij��ɫ��Һ��Na+��Ag+��Ba2+��Al3+�� [Al(OH)4]����CO32����SO32����SO42����MnO4���е���������ɣ�ȡ����Һ��������ʵ�飺
(��֪��Al3++3HCO3�� =Al(OH)3�� + 3CO2��)
��ȡ������Һ������������ᣬ����ɫ��ζ�������ɣ����õ���Һ��
���ڢ�������Һ���ټ������̼�������Һ�����������ɣ�ͬʱ������ɫ�����ס�
���ڢ�������Һ�м����������������Һ��Ҳ���������ɣ����а�ɫ������������
�����������ش��������⣺
��1����Һ��һ�����ڵ�������_____________________________________________��
��2����Һ��һ�������ڵ�������______________________________________________��
��3��֤����ɫ����������������������й����ӷ���ʽ��________________________��
______________________________________________________________��
��4���жϳ�������ɵ�ʵ�鷽����_________________________________________________________________________________________________________________________________________________________________________________��
���𰸡� Na����[Al(OH)4]����CO![]() Ag����Ba2����Al3����SO
Ag����Ba2����Al3����SO![]() ��MnO
��MnO![]() Al(OH)3��3H��===Al3����3H2O Al(OH)3��OH��===[Al(OH)4]����2H2O ȡ���������������Թ��У������������ᣬ������ȫ���ܽ⣬�������ΪBaCO3������������ȫ�ܽ⣬�������ΪBaCO3��BaSO4
Al(OH)3��3H��===Al3����3H2O Al(OH)3��OH��===[Al(OH)4]����2H2O ȡ���������������Թ��У������������ᣬ������ȫ���ܽ⣬�������ΪBaCO3������������ȫ�ܽ⣬�������ΪBaCO3��BaSO4
��������ij��ɫ��Һ��˵����Һ��һ��������ڸ�������������ټ���������ᣬ����ɫ��ζ�������ɣ����õ���ɫ��Һ�����ɵ������Ϊ������̼��������Һ��һ������CO32-��һ��������Ag+��Ba2+��Al3+��SO![]() ��������ֻʣ���������ӣ�������Һһ���ʵ����Կ�֪��Һ��һ������Na+�����ڢ�������Һ�м������NH4HCO3��Һ�����������ɣ�����Ϊ������������̼����立�Ӧ���ɵĶ�����̼��ͬʱ������ɫ�����ף���ɫ������Ϊ����������ԭ��Һ��һ������AlO2-�����ڢ�������Һ�м������Ba(OH)2��Һ��Ҳ���������ɣ�����Ϊ������ͬʱ������ɫ�����ң���ɫ����һ������̼�ᱵ�����ܺ������ᱵ��
��������ֻʣ���������ӣ�������Һһ���ʵ����Կ�֪��Һ��һ������Na+�����ڢ�������Һ�м������NH4HCO3��Һ�����������ɣ�����Ϊ������������̼����立�Ӧ���ɵĶ�����̼��ͬʱ������ɫ�����ף���ɫ������Ϊ����������ԭ��Һ��һ������AlO2-�����ڢ�������Һ�м������Ba(OH)2��Һ��Ҳ���������ɣ�����Ϊ������ͬʱ������ɫ�����ң���ɫ����һ������̼�ᱵ�����ܺ������ᱵ��
(1)�����Ϸ�����֪��Һ��һ�����ڵ������У�CO32-��Na+��AlO2-���ʴ�Ϊ��CO32-��Na+��AlO2-��
(2)һ��������SO![]() ��MnO4-��Ag+��Ba2+��Al3+���ʴ�Ϊ��SO
��MnO4-��Ag+��Ba2+��Al3+���ʴ�Ϊ��SO![]() ��MnO4-��Ag+��Ba2+��Al3+��
��MnO4-��Ag+��Ba2+��Al3+��
(3)֤�������������������������Ҫ֤�������������������ᷴӦ���������������Ʒ�Ӧ���ɣ��й����ӷ���ʽΪAl(OH)3��3H��=Al3����3H2O�� Al(OH)3��OH��=[Al(OH)4]����2H2O���ʴ�Ϊ��Al(OH)3��3H��=Al3����3H2O��Al(OH)3��OH��=[Al(OH)4]����2H2O��
(4)��ɫ������һ������̼�ᱵ�����ܺ������ᱵ���ɼ���������飬����������ܽ⣬����̼�ᱵ�����ᱵ�������ȫ���ܽ⣬��ֻ��̼�ᱵ���ʴ�Ϊ��ȡ���������������Թ��У������������ᣬ������ȫ���ܽ⣬�������ΪBaCO3������������ȫ�ܽ⣬�������ΪBaCO3��BaSO4��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦA(g)+3B(g)![]() 2C(g) ������Ӧ���ȣ��ﵽƽ�������������¶Ƚ��ͣ�����������ȷ����
2C(g) ������Ӧ���ȣ��ﵽƽ�������������¶Ƚ��ͣ�����������ȷ����
A. ����Ӧ���������淴Ӧ���ʱ�С��ƽ��������Ӧ�����ƶ�
B. ����Ӧ���ʱ�С���淴Ӧ��������ƽ�����淴Ӧ�����ƶ�
C. ����Ӧ���ʺ��淴Ӧ���ʶ���С��ƽ��������Ӧ�����ƶ�
D. ����Ӧ���ʺ��淴Ӧ���ʶ���С��ƽ�����淴Ӧ�����ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����о�������ʵĵ��롢�����ˮ�����Һ������Ũ�ȴ�С�Ƚ��У�ijʦ����ͬ��������һ��ʵ�飺�����£���20.0mL��0.1mol/L CH3COOH��Һ����μ���0.01mol/L NaOH��Һ�����ڵμӹ����в�����pH�Ʋ��������Һ��pH�����pH��V��NaOH��ͼ����ͼ��ʾ���������

��1���ڵμ�NaOH��Һ�����������е���Һ�����ʵı仯�����a��b��c��d��������ʸ���ʲô��
��2��CH3COOH��NaOHǡ����ȫ��Ӧ�ĵ���ͼ���е�λ���� �����ڡ����pH>7��pH<7�� pH=7�����ɴ˿���֤CH3COOHΪ ��������ǿ�ᣩ��ʱ���μ�V��NaOH��= mL��
��3��������ʵ���Ϊ�к͵ζ�ʵ��Ӧ�� ��Ϊָʾ����
��4������NaOH�ļ��룬ˮ�ĵ����ܵ�һ����Ӱ�죬��ˮ�ĵ���ﵽ���ʱ��Һ�е�����Ϊ ��
��5�������pHΪ7ʱ����ȥV(NaOH)=VmL������V�ı���ʽ��ʾ��ʱCH3COOH�ĵ���ƽ�ⳣ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����³ʿ���Ļ�ѧʽΪFe4[Fe��CN��6]3���������д��ڵĻ�ѧ�������Ӽ���
_____��_____�����е�Fe3+�ĺ�������Ų�ʽΪ______��
��2��KCN�ɱ�H2O2����ΪKOCN
��KOCN����Ϊ��ҩԭ�ϣ��侧��������____��̼ԭ�Ӳ�ȡsp�ӻ���1mol�������к��еĦм���ĿΪ______�����е����ַǽ���Ԫ�صĵ縺���ɴ�С��˳����______��
��H2O2��������Һ�壬�е�ϸߣ�150�棩������Ҫԭ����______��
��3������ſڴƻơ��еĴƻƷ���ʽΪAs2S3�����ӽṹ������ͼ��Asԭ�ӵ��ӻ���ʽΪ___���ƻƺ�SnCl2�������з�Ӧת��Ϊ�ƻƣ�As4S4����SnCl4��SnCl4���ӵĿռ乹��Ϊ______��

��4��ij����ľ����ṹ������ͼ��ʾ���þ���Ļ�ѧʽΪ_____���þ�������Ϊa=250.4pm��c=666.1pm��y=120o��1��ԭ������Ϊ��0��0��0����2��ԭ������Ϊ��1/3��2/3,0������3��ԭ������Ϊ_____����������������A��B��ԭ�Ӽ����С�˼��Ϊ____����������λ��Ч���֡���֪![]() =1.141��
=1.141�� ![]() =1.732.��
=1.732.��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͬ���ʵ�����SO2��SO3 �� ����˵������ȷ���ǣ� ��
A.��Ԫ�ص�������Ϊ5��4
B.������֮��Ϊ1��1
C.ԭ������֮��Ϊ4��3
D.����֮��Ϊ1��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڵ������Һ��������ȷ����
A. �����µ��볣��ΪKa����HA��Һ��c(H+)![]() mol��L-1
mol��L-1
B. ��0.1 mol��L-1�İ�ˮ�м�����������粒��壬����Һ��c(OH-)/c(NH3��H2O)����
C. 0.2 mol��L-1CH3COOH��Һ��0.1 mol��L-1NaOH��Һ��������
2c(H+)-2 c(OH-)=c(CH3COO-)- c(CH3COOH)
D. ������Na2SO4��Һ���뵽����ʯ��ˮ�У��а�ɫ����������˵��Ksp[Ca(OH)2]����Ksp(CaSO4)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������ʹ�õ�ȼ����ƫ������(C2H8N2)����ʹ��������������Ϊ��������������ϵ������ŵ��ǣ������ڶ�ʱ���ڲ������������������̫�գ������ֲ���Ⱦ����(���ﶼ�ǿ����ɷ֣���ijУ���о���ѧϰС���⽫��ԭ�����Ϊԭ��أ���ͼ��ʾ�����ѧϰ���ĵ绯ѧԭ����������Ʒ���������˵����ȷ���ǣ� ��

A. A����
B. ��ع���ʱH+��A����B��Ǩ��
C. ��b ��ͨ��������������������B������������Ӧ
D. A�������ĵ缫��Ӧʽ��C2H8N2+4H2O+16e-=2CO2+N2+16H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�����������ͬλ�ص���___________������ͬ���칹�����_________,����ͬһ���ʵ���__________��
��1��O2��O3
��2��3517Cl��3717Cl
��3��CH3CH3��CH3CH2CH2CH3
��4�����ʯ��ʯī
��5��뭡�뮡��
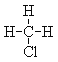
��6��CH3CH2CH2CH(CH3)CH2CH3��CH3CH2CH(CH3)CH(CH3)CH3
��7��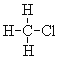 ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Fe2+��I-��Br-����Һ��ͨ��������������Һ�����������ӵ����ʵ����������������ʵ����ı仯��ͼ��ʾ������˵���в���ȷ���ǣ�������

A. �߶����Br-�ı仯���
B. aֵ����8
C. �߶�I����I-�ı仯���
D. ԭ�����Һ��n��Fe2+��=4mol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com