
【题目】向仅含Fe2+、I-、Br-的溶液中通入适量氯气,溶液中这三种离子的物质的量随消耗氯气物质的量的变化如图所示.下列说法中不正确的是( )

A. 线段Ⅲ代表Br-的变化情况
B. a值等于8
C. 线段I代表I-的变化情况
D. 原混合溶液中n(Fe2+)=4mol
【答案】B
【解析】向仅含Fe2+、I-、Br-的溶液中通入适量氯气,还原性I->Fe2+>Br-,首先发生反应2I-+Cl2=I2+2Cl-,I-反应完毕,再反应反应2Fe2++Cl2=2Fe3++2Cl-,Fe2+反应完毕,最后发生反应2Br-+Cl2=Br2+2Cl-,故线段I代表I-的变化情况,线段Ⅱ代表Fe2+的变化情况,线段Ⅲ代表Br-的变化情况;由通入氯气可知,根据反应离子方程式可知溶液中n(I-)=2n(Cl2)=2mol,溶液中n(Fe2+)=2n(Cl2)=2×(3mol-1mol)=4mol,Fe2+反应完毕,根据电荷守恒可知n(I-)+n(Br-)=2n(Fe2+),故n(Br-)=2n(Fe2+)-n(I-)=2×4mol-2mol=6mol;A.由上述分析可知,线段Ⅲ代表Br-的变化情况,故A正确;B.由上述分析可知,溶液中n(Br-)=2n(Fe2+)-n(I-)=2×4mol-2mol=6mol,根据2Br-+Cl2=Br2+2Cl-可知,溴离子反应需要的氯气的物质的量为3mol,故a=3+3=6,故B错误;C.由上述分析可知,线段I代表I-的变化情况,故C正确;D.由上述分析可知,n(Fe2+)=4mol,故D正确;故选B。


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案科目:高中化学 来源: 题型:
【题目】某无色溶液由Na+、Ag+、Ba2+、Al3+、 [Al(OH)4]-、CO32-、SO32-、SO42-、MnO4-中的若干种组成,取该溶液进行如下实验:
(已知:Al3++3HCO3- =Al(OH)3↓ + 3CO2↑)
①取适量试液,加入过量盐酸,有无色无味气体生成,并得到溶液。
②在①所得溶液中再加入过量碳酸氢铵溶液,有气体生成,同时析出白色沉淀甲。
③在②所得溶液中加入过量氢氧化钡溶液,也有气体生成,并有白色沉淀乙析出。
根据上述现象,回答下列问题:
(1)溶液中一定存在的离子是_____________________________________________;
(2)溶液中一定不存在的离子是______________________________________________;
(3)证明白色沉淀甲是两性氢氧化物的有关离子方程式是________________________;
______________________________________________________________。
(4)判断沉淀乙组成的实验方法是_________________________________________________________________________________________________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的Ca2+ 、Mg2+ 、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作。其正确的顺序是①过滤 ②加过量的NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤ 加过量BaCl2 溶液
A.①④②⑤③ B.④①②⑤③ C.②⑤④①③ D.②④①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子液体在有机合成、无机合成等方面有着重要应用。咪唑是合成“离子液体”的一种原料,其结构如图所示。下列有关咪唑说法不正确的是
![]()
A. 化学式C3H4N2
B. 分子中含有一种非极性键和两种极性键
C. 可以发生取代、加成、氧化反应
D. 一氯取代物的同分异构体共有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2在工业上具有广泛的用途,例如用作干电池去极剂、合成工业的催化剂和氧化剂,玻璃工业和搪瓷工业的着色剂、消色剂、脱铁剂等。
I.在实验室中,可以用MnO2催化分解H2O2或KClO3制备O2。
(1)设计简单的实验验证MnO2对H2O2的分解起催化作用________。
(2)如果用MnO2催化分解KCIO3制备并收集O2,应选用的实验装置是_______。

若用B装置制备少量的NH3,则a中盛放的药品是_______。
II.MnO2是实验室中常见的氧化剂,某化学兴趣小组探究在常温下,MnO2能否氧化酸性NaI溶液。可选用的试剂和仪器有:0.5mol/LNaI溶液,稀硫酸、稀盐酸、CCl4、酒精、分液漏斗、烧杯、漏斗、玻璃棒、酒精灯、温度计、牛角管、锥形瓶、石棉网、铁架台(带铁圈、铁夹)。
实验的步骤如下:
①在小烧杯中加入15mLNaI溶液,加硫酸使其酸化,加适量的MnO2,充分搅拌。
②将所得溶液过滤,观察滤液颜色。
③向滤液中加入5mL萃取剂,充分振荡。
④置于铁架台铁圈上静置。
⑤分液。
⑥将下层得到的含I2溶液进行蒸馏使得到单质I2。
请回答下列问题:
(1)写出步骤①中发生的离子方程式___________。
(2)观察步骤②所得滤液的颜色为_______,初步判定有单质I2生成。
(3)萃取滤液中的碘单质所用的仪器名称为_______,选择的萃取剂是______。
(4)步骤④静置后,观察到的现象是_______。
(5)简述分液的操作:________。
(6)步骤⑥中组装蒸馏装置还缺少的仪器是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作均要用玻璃棒,其中玻璃棒用作引流的是( ) ①过滤 ②蒸发 ③溶解 ④向容量瓶转移液体.
A.①和②
B.①和③
C.③和④
D.①和④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质存在如下图所示的转化关系(反应条件、部分产物未标出),已知某物质X是一种正盐,E是强酸
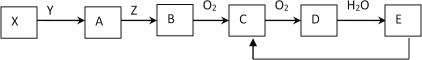
试回答下列问题:
(1)若Y为强酸,且B为黄色固体单质
①从组成物质的元素化合价变化角度预测C可能具有的性质_______________
②一定条件下E转化为C有多种途径,写出其中一种转化的化学反应方程式_______________________。
(2) 若Y为强碱,且B为空气中含量最高的气态单质
①写出实验室制取A的化学方程式______________________________________。
②若A→B的转化常用来检验Z气体管道的是否漏气,用该方法检验的现象是____________________,
其化学反应方程式_________________________________________。
③C、D都是大气污染物,它们对环境造成的危害表现在_______。
A.引起酸雨 B.引起温室效应
C.形成光化学烟雾 D.引起水体富营养化
④将x mL C、y mL D混合于同一试管中,将试管倒置于水中,同时通入z mL O2充分反应后,试管内气体全部消失,则x:y:z不可能是 _______________
A 1:1:1 B 2:1:1
C 3:7:4 D 1:5:2
(3)无论Y为强酸或强碱均符合上述转化,则物质X的化学式_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组探究少量Cl2和FeBr2反应的过程。
(1)配制FeBr2溶液:
ⅰ.配制50mL1.0mol/LFeBr2溶液;
ⅱ.上述溶液呈淡黄色。取少量此溶液,向其中滴入KSCN溶液,变为浅红色。
①配制50mL1.0mol/LFeBr2溶液需要的玻璃容器是________________。
②由ⅱ可知,此FeBr2溶液呈黄色的原因是其中含有________,用离子方程式解释产生其原因:_______。
(2)氯气和FeBr2反应实验操作及现象如下:
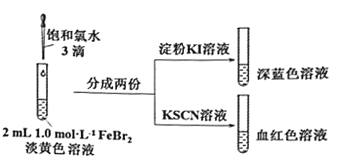
据此甲同学得出结论:少量Cl2既能和Fe2+又能和Br-发生氧化还原反应。
①Cl2和Fe2+发生反应的离子方程式是________________。
②乙同学认为上述实验不能证明Cl2和Br-发生反应,理由是_____________。
③乙同学改进实验如下:在上述FeBr2溶液中加入过量铁粉,取上清液2 mL,向其中滴加3滴饱和氯水后,再加入CCl4,振荡后静置,观察现象。乙得出结论:少量Cl2只与Fe2+反应,不与Br-反应。乙得出该结论依据的实验现象是____________________。
(3)丙同学继续设计实验,探究反应过程:
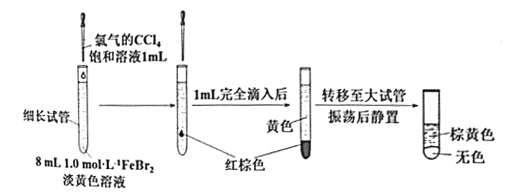
①转移到大试管前CCl4液体中呈红棕色的物质是___________。
②丙通过此实验可得出结论:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于常温下的溶液叙述正确的是
A.Mg(OH)2可溶于一定浓度的NH4Cl溶液
B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为u和u+1,则c1=10c2
C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈蓝色
D.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO![]() )>c(NH
)>c(NH![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com