
分析 (1)碘不易溶于水,易溶于有机溶剂;
(2)分液时避免上下层液体混合,苯的密度比水的小,溶解溴的苯在上层;
(3)酒精与四氯化碳互溶.
解答 解:(1)酒精与水互溶,由信息可知,能把碘单质从碘水中萃取出来的是苯、四氯化碳,进行分液之后,碘溶解在有机溶剂中,不能得到纯净的碘单质,
故答案为:苯、四氯化碳;不能;
(2)能把溴从溴水中萃取出来,并在分液时使含溴的液体从分液漏斗上口倒出的是苯;萃取时,上层液体呈现的颜色是橙色.分液漏斗在使用之前必须进行的操作是检漏,故答案为:苯;橙色;检漏;
(3)酒精与四氯化碳互溶,则不能利用CCl4把碘酒中的碘萃取出来,故答案为:不能,因为四氯化碳与酒精互溶.
点评 本题考查混合物分离提纯,为高频考点,把握有机物的性质、萃取原理为解答的关键,侧重分析与应用能力的考查,注意萃取剂的选择,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 如图为相互串联的甲乙两个电解池,甲池若为电解精炼铜的装置,请回答:
如图为相互串联的甲乙两个电解池,甲池若为电解精炼铜的装置,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH、FeCl3、H2SO4 | B. | HCl、K2CO3、BaCl2 | ||
| C. | CuSO4、HCl、KOH | D. | BaCl2、HNO3、AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 随原子序数递增,ⅦA族元素的最高价氧化物对应水化物酸性逐渐增强 | |
| B. | 第三周期元素中(除稀有气体元素)简单离子半径最小的元素,其氧化物具有两性 | |
| C. | 第三周期气态氢化物的沸点均为同主族中沸点最低的,是因为其分子内含有氢键 | |
| D. | 第二周期元素(除稀有气体元素)的最高化合价数值逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.5s | B. | 4s | C. | 5s | D. | 10s |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定有一种元素被氧化,另一种元素被还原 | |
| B. | 反应中电子可以在同种元素间转移 | |
| C. | 非金属单质在反应中只作氧化剂 | |
| D. | 金属原子失电子越多,其还原性越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知C(石墨,s)═C(金刚石,s)△H﹦+1.9kJ•mo1-1,说明金刚石具有的能量比石墨低 | |
| B. | 已知H+(aq)+OH-(aq)═H2O(1)△H﹦-57.4KJ•mo1-1,20g氢氧化钠固体溶于稀盐酸中恰好完全反应时放出的热量大于28.7kJ | |
| C. | 已知甲烷的燃烧热为890.3kJ•mo1-1,则表示甲烷燃烧热的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H﹦-890.3kJ•mo1-1 | |
| D. | 将0.5mo1N2和1.5mo1H2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H﹦-38.6kJ•mo1-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
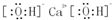 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
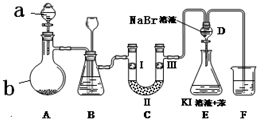 实验室用如图所示装置制备氯气并进行一系列相关的实验(夹持设备已省略).
实验室用如图所示装置制备氯气并进行一系列相关的实验(夹持设备已省略).| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 无水氯化钙 | 浓硫酸 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com