
【题目】煤燃烧排放的烟气含有NOx,容易形成酸雨污染环境,可通过多种化学方法对烟气进行脱硝处理。回答下列问题:
(1)在无氧条件下,脱硝反应为:6NO(g)+4NH3(g)5N2(g)+6H2O(g)△H=-1807.0kJmol-1,T℃时,在恒容的密闭容器中,测得在不同时间NO和NH3的物质的量如下表:
时间/min | 0 | 1 | 2 | 3 | 4 |
n(NO)/mol | 1.20 | 0.90 | 0.72 | 0.60 | 0.60 |
n(NH3)/mol | 0.90 | 0.70 | 0.58 | 0.50 | 0.50 |
①下列说法正确的是______(填序号)。
A.3min后NO和NH3的浓度都不再变化,反应停止进行
B.前2min内的平均反应速率v(N2)=0.20molL-1min-1
C.达到平衡时NO的转化率为50%
D.及时分离出N2,可使该反应的反应速率增大,平衡正向移动
②若反应开始的压强为p0,则该反应的化学平衡常数Kp=______(可用分数表示;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)在有氧条件下,NOx也能发生脱硝反应。
①已知:N2(g)+O2(g)=2NO(g)△H=180.6kJmol-1
N2(g)+3H2(g)2NH3(g)△H=-92.4kJmol-1
H2O(g)=H2(g)+![]() O2(g)△H=241.8kJmol-1
O2(g)△H=241.8kJmol-1
则脱硝反应4NO(g)+4NH3(g)+O2(g)=4N2(g)+6H2O(g)△H=______kJmol-1
②臭氧是理想的烟气脱硝剂,其脱硝反应为2NO2(g)+O3(g)N2O5(g)+O2(g)△H<0,反应在恒容密闭容器中进行,NO2的百分含量随压强(p)、x的变化如图所示:
则p1______p2(填“>”“<”或“=”),x表示的物理量除时间外,还可能是______。
(3)利用惰性电极电解也能对烟气进行脱硝处理。电解原理如图所示:

电极a的电极反应式为______,当电解44.8L(标准状况)含5%NO的烟气,理论上电路中通过电子的物质的量为______mol。
【答案】C ![]() p0 -1627.2 > O3的物质的量或其浓度或质量等 NO -3e + 2H2O = NO3 +4H+ 0.3
p0 -1627.2 > O3的物质的量或其浓度或质量等 NO -3e + 2H2O = NO3 +4H+ 0.3
【解析】
(1)①A. 化学反应平衡为动态平衡,正逆反应速率相等但不等于0;
B. 由化学反应速率的定义可知,需要容器的体积;
C. 根据转化率的计算公式得出结论;
D. 反应物或生成物的浓度降低,化学反应速率会减小;
②列出三段式,利用分压表达出化学平衡常数。
(2)①依据热化学方程式和盖斯定律计算得到所需热化学方程式;
②该脱硝反应是气体体积分数减小的反应,增大压强会使平衡向正反应方向移动,导致NO2的百分含量降低,据图分析;根据平衡移动原理进行分析,NO2的百分含量会随着参加反应的O3的量的增大而减少;
(3)依据图中b口放出氢气,可知b为连接电源的负极,作电解池的阴极,则a极发生氧化反应,NO转化为NO3,每消耗1 mol NO,转移电子数为 3 mol,据此计算。
①A. 3min后NO和NH3的浓度都不再变化,说明达到动态平衡,但速率不为零,故A项错误;
B. 容器的体积未知,其化学反应速率无法求出,故B项错误;
C. 3min后NO的浓度不再变化,达到平衡,n(NO) = 0.6 mol,则转化的NO的物质的量 = 1.2 mol-0.6 mol = 0.6 mol,故其转化率 = ![]() ×100% = 50%,故C项正确;
×100% = 50%,故C项正确;
D. 分离出N2,其浓度降低,反应的速率会减小,故D项错误;
故答案选C;
②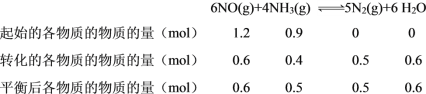
则平衡后H2O的物质的量分数ω(H2O) = ![]() =
= ![]() ,同理可得ω(N2) =
,同理可得ω(N2) = ![]() , ω(NH3) =
, ω(NH3) = ![]() , ω(NO) =
, ω(NO) = ![]() , 反应开始的压强为p0,物质的量为1.2 mol +0.9 mol = 2.1 mol,则反应后的总压p =
, 反应开始的压强为p0,物质的量为1.2 mol +0.9 mol = 2.1 mol,则反应后的总压p = ![]() =
= ![]() ,其平衡常数Kp =
,其平衡常数Kp =  =
= ![]() =
= ![]() =
= ![]() p0,
p0,
故答案为:![]() p0;
p0;
(2)①i.N2(g)+O2(g)═2NO(g)△H=+180.6kJmol-1
ii.N2(g)+3H2(g)=2NH3(g)△H=-92.4kJmol-1
iii.2H2(g)+O2(g)═2H2O(g)△H=-483.6kJmol-1
依据盖斯定律iii×3-ii×2-i×2得到,4NO(g)+4NH3(g)+O2(g)═4N2(g
故答案为:-1627.2;
②2NO2(g)+ O3(g) ![]() N2O5(g)+ O2(g),该反应为气体体积减小的反应,因此增大压强平衡会向正向移动,NO2的百分含量降低,从图中可以看出,p1压强大,即p1> p2;增大某一反应物的浓度可以使化学平衡向正反应方向移动,从而提高另一反应物的转化率、减小其百分含量,故x表示的物理量除时间外,还可能是O3的物质的量或其浓度或质量等;
N2O5(g)+ O2(g),该反应为气体体积减小的反应,因此增大压强平衡会向正向移动,NO2的百分含量降低,从图中可以看出,p1压强大,即p1> p2;增大某一反应物的浓度可以使化学平衡向正反应方向移动,从而提高另一反应物的转化率、减小其百分含量,故x表示的物理量除时间外,还可能是O3的物质的量或其浓度或质量等;
故答案为:>;O3的物质的量或其浓度或质量等
(3)根据图示信息可知,b口产生氢气,则为溶液中的氢离子得电子的产物,电解池中阳离子在阴极得电子发生还原反应,故b连接电源的负极,a连接电源的正极,其阳极区NO失电子被氧化为硝酸根离子,发生的电极反应式为:NO -3e + 2H2O = NO3 +4H+,电解的烟气中NO的物质的量 = ![]() = 0.1 mol,所以转移的电子数为0.1mol×3 = 0.3 mol,
= 0.1 mol,所以转移的电子数为0.1mol×3 = 0.3 mol,
故答案为:NO -3e + 2H2O = NO3 +4H+;0.3。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应)。请回答下列问题:
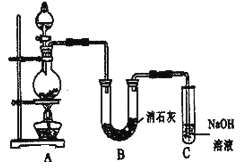
(1)A、B中的反应物分别是浓盐酸和MnO2。写出所发生的化学方程式__________,进入装置C的气体中所含杂质是_____、_____。
(2)漂白粉的有效成分是____(填化学式);D中所发生的化学反应的离子方程式是_______。
(3)此实验所得漂白粉的Ca(ClO)2产率偏低。该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应: ①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是__。②为避免另一副反应的发生,应采取的措施是________。
(4)若将该实验中残留的Cl2,缓慢通入KI溶液至过量,则溶液先变黄后变无色,且可检测到HIO3;写出并配平该“变无色”反应的化学方程式:________,若将KI改为KBr溶液,则溶液变为__色,未检测到HBrO3的存在。由上述事实推测,Cl2、HIO3、HBrO3的氧化性由强到弱的次序是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代火法炼锌过程中发生了以下三个主要反应。下列说法正确的是
① 2ZnS(s) + 3O2(g)=2ZnO(s)+2SO2(g) △H1=a kJ mol-1
② 2C(s) +O2(g)=2CO(g) △H2=b kJ mol-1
③ ZnO(s) +CO(g)=Zn(g) +CO2(g) △H3=c kJ mol-1
A. 以上三个反应中,只有①是放热反应
B. 反应②的作用是仅为反应③提供还原剂
C. 用这种方法得到的是纯净的锌单质
D. 反应ZnS(s)+C(s)+2O2(g)=Zn(g)+SO2(g)+CO2(g)的△H=![]() kJ mol-1
kJ mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组拟合成医药中间体X。

请回答:
(1)下列说法正确的是_________。
A.化合物B不能使溴水褪色
B.化合物C能与CuO发生氧化反应
C.化合物D的分子式是C9H10O2Br
D.化合物E到F发生的是加成反应
(2)化合物H的结构简式是________。
(3)已知I→X是取代反应,写出该反应的化学方程式________。
(4)化合物G的同分异构体有以下特征:①含有苯环;②1H﹣NMR谱显示分子中有3种氢原子;③分子结构中不存在氧氧键。请写出所有符合要求的结构简式(或键线式)___。
(5)已知:①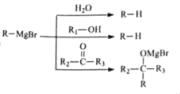 ;②
;② ,请结合题目中已知信息设计由
,请结合题目中已知信息设计由![]() 合成
合成![]() 的路线________________________(用流程图表示)。
的路线________________________(用流程图表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某体积可变的密闭容器中盛有适量的N2和H2的混合气体,在一定条件下发生反应:N2(g)+3 H2 (g)![]() 2NH3(g),若维持温度和压强不变,当达到平衡时,容器的体积为V L,其中NH3的体积是0.1 V L。下列说法正确的是
2NH3(g),若维持温度和压强不变,当达到平衡时,容器的体积为V L,其中NH3的体积是0.1 V L。下列说法正确的是
A. 原混合气体的体积为1.2V L B. 反应达平衡时N2消耗掉0.2 V L
C. 原混合气体的体积为1.1VL D. 反应达平衡时H2消耗掉0.5 V L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在生产生活中用途广泛。回答下列问题:
(1)目前,低压甲醇铜基催化剂的主要组分是CuO、ZnO和Al2O3,下列氧原子电子排布图表示的状态中,能量最高的是______(填序号)。
A.
B.
C.
D.
(2)铜离子是人体内多种酶的辅因子,某化合物与Cu+结合形成如下图所示的离子。

①该离子中含有化学键的类型有______(填序号)。
A.极性键 B.离子键 C.非极性键 D.配位键
②该离子中碳原子的杂化方式有______。
③H、N、Cu三种元素的电负性由大到小的顺序是______。
(3)甲醇(CH3OH)在Cu催化作用下被氧化成甲醛(HCHO)。甲醛分子内σ键与π键个数之比为______。甲醇分子内的O-C-H键角______(填“大于”“等于”或“小于”)甲醛分子内的O-C-H键角。
(4)某磷青铜晶胞结构如下图所示:

①其中原子坐标参数A为(0,0,0);B为(0,![]() ,
,![]() )。则P原子的坐标参数为______。
)。则P原子的坐标参数为______。
②该晶体中距离Cu原子最近的Sn原子有______个,这些Sn原子所呈现的构型为______。
③若晶体密度为agcm3,最近的Cu原子核间距为______pm(用含NA和a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取镁,可按如下步骤进行:
①把贝壳制成石灰乳;
②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;
③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物;
④将得到的产物熔融电解得到镁。
下列说法不正确的是( )
A. 此法的优点之一是原料来源丰富B. ①②③步骤的目的是从海水中提取镁盐
C. ①②③步骤涉及化合、分解和复分解反应D. 第①到第④步的反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲配制100mL 1.0 mol/L Na2CO3溶液,正确的方法是
① 将10.6 g Na2CO3 溶于100mL水中
② 将28.6g Na2CO3·10H2O溶于水配成100 mL溶液
③ 将20 ml 5.0 mol/L Na2CO3溶液加水稀释至100 mL
A. ①②③ B. ②③ C. 只有② D. 只有③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,稀盐酸和氨水按不同体积比混合得到四种溶液,各取20mL溶液,用0.1molL﹣1NaOH溶液滴定,溶液的pH随NaOH溶液的体积变化如图所示,下列说法正确的是( )

A. 滴至pH=7时,四种溶液中均存在c(Na+)=c(Cl﹣)
B. 原盐酸的浓度是0.1molL﹣1
C. V(NaOH)=10mL,溶液中Na+浓度a>b
D. 当V(NaOH)>20mL时,四种溶液的pH相同,溶液中的NH4+浓度近似相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com