

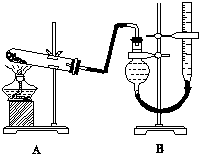
分析 (1)实验时,先装入药品,然后通入二氧化碳,将容器中的水蒸气、氧气等排除,加热反应,反应完毕后,继续通入二氧化碳,将装置内的氯气、CO等排出;
(2)装置A中用于制备氯气,反应加热,应为二氧化锰和浓盐酸的反应;
(3)四氯化钛极易水解,能与装置中的空气里的水蒸气反应;
(4)反应中有未反应的氯气及挥发出来的氯化氢,会污染空气,所以要用氢氧化钠溶液进行尾气吸收;
(5)TiCl4极易与空气中的水反应,产物之一遇水形成白雾,说明发生化学反应生成Ti(OH)4和氯化氢气体;
(6)在800℃高温和氩气氛围中还原TiCl4的方法制备钛,目的是为了防止金属被空气中的氧气氧化.
解答 解:(1)实验时,先装入药品,然后通入二氧化碳,将容器中的水蒸气、氧气等排除,加热反应,反应完毕后,继续通入二氧化碳,将装置内的氯气、CO等排出,操作顺序为③①④②,
故答案为:③①④②;
(2)装置A中用于制备氯气,反应加热,应为二氧化锰和浓盐酸的反应,反应的离子方程式为MnO2+4H++2 Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(3)四氯化钛极易水解,能与装置中的空气里的水蒸气反应,所以在通Cl2前先通入CO2气体并持续一段时间,排尽装置中的空气,避免TiCl4 遇空气中水蒸气发生水解,
故答案为:排尽装置内的空气,避免TiCl4 遇空气中水蒸气发生水解;
(4)反应中有未反应的氯气及挥发出来的氯化氢,会污染空气,所以要用氢氧化钠溶液进行尾气吸收,所以E的作用是吸收多余的Cl2及挥发的HCl,以免污染空气,
故答案为:吸收多余的Cl2及挥发的HCl,以免污染空气.
(5)TiCl4极易与空气中的水反应,产物之一遇水形成白雾,化学方程式为:说明发生化学反应生成Ti(OH)4和氯化氢气体,反应的化学方程式为:TiCl4+4H2O═4HCl+Ti(OH)4 ,
故答案为:TiCl4+4H2O═4HCl+Ti(OH)4 ;
(6)工业上常用金属镁在800℃高温和氩气氛围中还原TiCl4的方法制备钛:TiCl4+2Mg$\frac{\underline{\;800℃\;}}{\;}$ Ti+2MgCl2,氩气的作用为防止Mg和Ti被空气中氧气氧化,
故答案为:防止Mg和Ti被空气中氧气氧化.
点评 本题考查物质的制备和性质探究,为高频考点,侧重于学生的分析能力和实验能力的考查,要根据实验原理提出假设,再结合物质的性质加以验证,侧重于考查学生的实验探究能力和对知识的应用能力,题目难度中等.


 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案科目:高中化学 来源: 题型:解答题
 3,3,5,5-四甲基庚烷;
3,3,5,5-四甲基庚烷; ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在恒容密闭容器中加入一定量的反应物后发生可逆反应:CO(g)+H2O(g)?CO2(g)+H2(g),平衡时 CO2(g)的物质的量浓度c(CO2)与温度T的关系如
在恒容密闭容器中加入一定量的反应物后发生可逆反应:CO(g)+H2O(g)?CO2(g)+H2(g),平衡时 CO2(g)的物质的量浓度c(CO2)与温度T的关系如| A. | 反应CO(g)+H2O(g)?CO2(g)+H2(g)的△H>0 | |
| B. | 在T2 时,若反应处于状态D,则一定有v正<v逆 | |
| C. | 平衡状态A 与C 相比,平衡状态A 的c(CO)小 | |
| D. | 若T1、T2时的平衡常数分别为K1、K2,则K1<K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝箔插入稀HNO3中,无现象,说明铝箔表面被HNO3氧化,形成致密的氧化膜 | |
| B. | 加入铝粉能产生H2的溶液中,可能存在大量的Na+、Ba2+、AlO2-、NO3- | |
| C. | 明矾可用于水的消毒,杀菌 | |
| D. | 向NaAlO2溶液中通入过量CO2的离子方程式为2AlO${\;}_{2}^{-}$+CO2+3H2O═2Al(OH)3↓+CO${\;}_{3}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:| 实验序号 | KClO3质量 | 其他物质质量 | 待测数据 |
| ④ | 1.2g | 无其他物质 | |
| ⑤[ | 1.2g | CuO 0.5g | |
| ⑥ | 1.2g | MnO2 0.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 聚合硫酸铁铝(PFAS)是一种新型高效水处理剂.利用硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)为铁源,粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为铝源,制备PFAS的工艺流程如图:
聚合硫酸铁铝(PFAS)是一种新型高效水处理剂.利用硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)为铁源,粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为铝源,制备PFAS的工艺流程如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 mol | B. | 11 mol | C. | 12 mol | D. | 13 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com