
【题目】碲(52Te)被誉为“现代工业、国防与尖端技术的维生素”,工业上常用铜阳极泥(主要成分是Cu2Te,含Ag、Au等杂质)为原料提取碲并回收金属,其工艺流程如下:

已知:TeO2是两性氧化物,微溶于水,易溶于较浓的强酸和强碱。回答下列问题:
(1)碲在元素周期表中的位置_______________。
(2)“加压酸浸1”过程中将碲元素转化成TeO2,应控制溶液的pH为4.5~5.0,酸度不能过高,原因是___________________,其中“加压”的目的是_______________,写出“加压酸浸1”过程中Cu2Te发生反应的化学方程式__________________________。
(3) “酸浸2”时温度过高会使碲的浸出率降低,原因为______________________,要从Ag和Au中分离出Au,可以向回收的Ag和Au中加入的试剂是_______________。
(4)写出“还原”反应中发生的离子方程式_______________________。
(5)工业上另一种提取碲的方法是将铜阳极泥在空气中焙烧,使碲转化成TeO2,再加NaOH碱浸,以石墨为电极电解溶液获得Te。电解过程中阴极的电极反应式为______。
【答案】第五周期第VIA族 溶液酸性过强,TeO2会继续与酸反应导致碲元素损失 增大O2浓度,加快反应速率,提高浸出率 Cu2Te+2O2+2H2SO4![]() 2CuSO4+TeO2+2H2O 温度升高,盐酸挥发,反应物浓度降低,导致浸出率降低 稀硝酸 Te4++2SO2+4H2O=Te↓+2SO42-+8H+ TeO32-+3H2O+4e-=Te+6OH-
2CuSO4+TeO2+2H2O 温度升高,盐酸挥发,反应物浓度降低,导致浸出率降低 稀硝酸 Te4++2SO2+4H2O=Te↓+2SO42-+8H+ TeO32-+3H2O+4e-=Te+6OH-
【解析】
(1)碲是52号元素,原子核外有5个电子层,最外层有6个电子,根据原子结构与元素位置关系判断其在元素周期表中的位置;
(2) “加压酸浸1”过程中控制溶液的pH为4.5~5.0,碲元素转化成TeO2,若酸度过高,根据TeO2是两性氧化物,微溶于水,易溶于较浓的强酸和强碱, “加压”可增大O2的溶解度,加快反应速率;可根据“加压酸浸1”过程中Cu2Te转化为TeO2,根据原子守恒、电子守恒,得发生反应的化学方程式;
(3) “酸浸2”时若温度过高,会使HCl挥发,反应物浓度降低,影响化学反应;可以从Ag与硝酸反应,而Au不能与酸反应分析加入的试剂;
(4)SO2具有还原性,可将TeO2 “还原”为Te,SO2被氧化为H2SO4,据此得反应的离子方程式;
(5)工业上另一种提取碲的方法是将铜阳极泥在空气中焙烧,使碲转化成TeO2,再加NaOH碱浸,然后以石墨为电极电解溶液,TeO2在阴极获得电子变为Te。据此得电解过程中阴极的电极反应式。
(1)碲是52号元素,原子核外有5个电子层,最外层有6个电子,根据原子核外电子层数等于元素所在的周期数,原子核外最外层电子数等于其所在的主族序数,所以碲位于元素周期表第五周期第VIA族;
(2)“加压酸浸1”过程中将碲元素转化成TeO2,溶液的pH控制在4.5~5.0,酸度不能过高,由于TeO2是两性氧化物,能够溶于强酸;其中“加压”的目的是增大O2的溶解度,加快反应速率;“加压酸浸1”过程中Cu2Te发生反应的化学方程式是Cu2Te+2O2+2H2SO4![]() 2CuSO4+TeO2+2H2O。
2CuSO4+TeO2+2H2O。
(3) “酸浸2”时若温度过高,会使HCl挥发,反应物浓度降低,使碲的浸出率降低;Au、Ag二者的混合物中分离出Au,可根据Ag能够被硝酸氧化,而Au不能反应,用浓硝酸将Ag氧化为Ag+,然后过滤、洗涤就得到纯净的Au;
(4)SO2具有还原性,可将TeO2 “还原”为Te,SO2被氧化为H2SO4,据此得反应的离子方程式Te4++2SO2+4H2O=Te↓+2SO42-+8H+;
(5)工业上另一种提取碲的方法是将铜阳极泥在空气中焙烧,使碲转化成TeO2,再加NaOH碱浸,然后以石墨为电极电解溶液,TeO2在阴极获得电子变为Te。则电解过程中阴极的电极反应式为:TeO32-+3H2O+4e-=Te+6OH-。


科目:高中化学 来源: 题型:
【题目】下列各组中,两种气体的分子数一定相等的是 ( )
A. 温度相同、体积相同的O2和N2 B. 体积相等、密度不等的CO和C2H4
C. 质量相等、密度不等的CO和C2H4 D. 压强相同、体积相同的O2和N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组为研究氯气的性质并模拟工业制备漂白粉,设计了下列装置进行实验。已知:①A中反应为 KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O;
②石灰乳的主要成分为Ca(OH)2,其他杂质不参与反应。

(1)B装置作用____。实验结束后,立即将 B 中溶液滴几滴在紫色石蕊试纸上,可观察到的现象是_____。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III处依次放入的物质正确的是___(填编号)。
编号 | I | II | III |
A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
B | 干燥的有色布条 | 浓硫酸 | 湿润的有色布条 |
C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
D | 湿润的有色布条 | 碱石灰 | 干燥的有色布条 |
(3)待E中物质完全反应后,经过一系列加工处理,得到漂白粉样品,其主要成份为___(填化学式)
(4)F装置的作用是(用化学方程式表示)____。
(5)为测定(3)中所得漂白粉的有效成份含量。称取ag漂白粉样品溶解,往所得溶液中通入 CO2至产生沉淀最大值时,该过程的化学方程式为_____,若反应生成沉淀的物质的量为bmol,则该漂白粉中有效成份的质量分数为_____(用含a、b的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D四种短周期元素在周期表中的相对位置如右表,其中D的原子序数是A的原子序数的3倍。A与D组成的物质是一种超硬耐磨涂层材料,图3为其晶体结构中最小的重复结构单元,其中的每个原子最外层均满足8电子稳定结构。下列有关说法正确的是

A. A与D组成的物质的化学式为BP,属于离子晶体
B. A与D组成的物质熔点高,且熔融状态下能导电
C. A与D组成的物质中原子间以共价键连接,属于原子晶体
D. A与D组成的化合物晶体中,每个A原子周围连接1个D原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨硼烷是一种有效、安全的固体储氢材料.氨硼烷的结构和乙烷相似,如图.
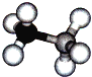
(1)氨硼烷的晶体类型为__.
(2)氮和硼比较,电负性大的元素为__(填元素符号).
(3)氨硼烷分子中氮原子、硼原子的杂化轨道类型分别为__和__.
(4)氨硼烷__(填“能”或“不能”)溶于水,其原因是__.
(5)以NaBH4为硼源、某配合物为氨源可用于制备氨硼烷.为测定该配合物的结构,取2.32g配合物进行如下实验:用重量法分析金属元素,测得镍元素的质量为0.59g;在碱性条件下加热蒸出NH3,用滴定法测出其物质的量为0.06mol;滴加过量硝酸银溶液,有白色沉淀生成,加热,沉淀没有增加;用摩尔法分析含量,测得氯元素质量为0.71g.
该配合物中镍离子的基态电子排布式为__.该配合物的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由![]() 和
和![]() 组成的混合气体与同温同压下空气的密度相等
组成的混合气体与同温同压下空气的密度相等![]() 空气的平均相对分子质量为29,
空气的平均相对分子质量为29,![]() 则下列关系正确的是()
则下列关系正确的是()
A.混合气体中,![]() 占有的体积大于
占有的体积大于![]() 占有的体积
占有的体积
B.混合气体中,![]() 与
与![]() 分子个数比为1:2
分子个数比为1:2
C.混合气体中,![]() 与
与![]() 质量比为15:14
质量比为15:14
D.混合气体中,![]() 与
与![]() 密度比为14:15
密度比为14:15
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯(C3H6)是重要的有机化工原料。丙烷脱氢制丙烯发生的主要反应及能量变化如下图。

(1)丙烷脱氢制丙烯为强吸热过程。
①为提供反应所需热量,恒压时若向原料气中掺入水蒸气,则K(主反应)____(填“增大”、“减小”或“不变”,下同),转化率α(C3H8)_____。
②温度升高,副反应更容易发生的主要原因是__________________________________。
(2)下图为丙烷直接脱氢法中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中的压强分
别为104 Pa和105 Pa)。

①104 Pa时,图中表示丙烯的曲线是____(填“ⅰ”、“ⅱ”、“ⅲ”或“ⅳ”)。
②104 Pa、500 ℃时,主反应用平衡分压代替平衡浓度表示的化学平衡常数Kp=_____(已知:气体分压=气体总压×体积分数)。
(3)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。
该工艺可采用铬的氧化物为催化剂,其反应机理如图。

已知:CO和H2的燃烧热分别为△H =-283.0 kJ·mol-1、△H =-285.8 kJ·mol-1。
①图中催化剂为______。
②298 K 时,该工艺总反应的热化学方程式为_____________________________________。
③该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 用20gNaOH配成250mL溶液,它的物质的量浓度为 ______
用20gNaOH配成250mL溶液,它的物质的量浓度为 ______ ![]() 取出5mL该溶液,它的物质的量浓度为 ______ ,再加水稀释至100mL,则稀释后溶液的物质的量浓度为 ______ ,其中含NaOH的质量为 ______
取出5mL该溶液,它的物质的量浓度为 ______ ,再加水稀释至100mL,则稀释后溶液的物质的量浓度为 ______ ,其中含NaOH的质量为 ______ ![]() 该100mL溶液可以跟
该100mL溶液可以跟![]() 的硫酸溶液 ______ mL完全中和生成
的硫酸溶液 ______ mL完全中和生成![]() .
.
![]() 气态化合物A的化学式可以表示为
气态化合物A的化学式可以表示为![]() ,已知同温同压下10mLA受热完全分解生成
,已知同温同压下10mLA受热完全分解生成![]() 和10mL
和10mL![]() ,则A的化学式为 ______ .
,则A的化学式为 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有Na2CO3和NaHCO3两种白色固体物质:
Ⅰ.欲探究Na2CO3和NaHCO3稳定性的相对强弱,两同学分别设计了以下两组装置:

请回答:
①如甲图所示,分别用Na2CO3和NaHCO3做实验,试管②中的试剂是______(填字母序号)。
a. 稀H2SO4 b. NaOH溶液 c. Ca(OH)2溶液
②如乙图所示,试管④中装入的固体应该是______________(填化学式)。
③通过上述实验,得出的结论是:Na2CO3比NaHCO3的稳定性______(填“强”或“弱”)。
Ⅱ.欲鉴别两种固体物质可选用的试剂是_____________。
Ⅲ.等物质的量浓度的两种物质的溶液与同浓度的盐酸反应,反应速率快的是_________(填化学式)。
(2)甲、乙、丙三位同学分别用如下三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气。请回答下列问题:



①实验室制取氨气的化学方程式为:________________________________________;
②三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨气(假设他们的实验操作都正确),你认为没有收集到氨气的同学是___________(填“甲”、“乙”或“丙”),收集不到氨气的主要原因是___________________________(用化学方程式表示);
③检验氨气是否收集满的方法是(简述操作方法、现象和结论)_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com