
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.4.2g乙烯和环丁烷的混合气中含有氢原子的数目为0.6NA
B.0.2 mol丁烯醛中含有双键的数目为0.2NA
C.常温常压下,22.4 L丙炔中含有分子的数目为NA
D.标准状况下,11.2 L甲醇中含有分子的数目为0.5NA
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】过氧化钙是一种白色固体,微溶于冷水,不溶于乙醇,化学性质与过氧化钠类似。某学习小组设计在碱性环境中利用CaCl2与H2O2反应制取CaO2·8H2O,装置如图所示:
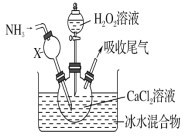
(1)小组同学查阅文献得知:该实验用质量分数为20%的H2O2溶液最为适宜。市售H2O2溶液的质量分数为30%。该小组同学用市售H2O2溶液配制约20%的H2O2溶液的过程中,使用的玻璃仪器除玻璃棒、胶头滴管外,还有_____________。
(2)在冰水浴中进行的原因是_____________________。
(3)实验时,在三颈烧瓶中析出CaO2·8H2O晶体,总反应的离子方程式为________________________。
(4)若CaCl2原料中含有Fe3+杂质,Fe3+催化分解H2O2,会使H2O2的利用率明显降低。反应的机理为:
① Fe3+ + H2O2 = Fe2+ + H+ + HOO·
② H2O2 + X = Y + Z + W(已配平)
③ Fe2+ +·OH = Fe3+ + OH-
④ H+ + OH- = H2O
根据上述机理推导步骤②中的化学方程式为___________________________。
(5)过氧化钙可用于长途运输鱼苗,这体现了过氧化钙具有_____________的性质。
A.与水缓慢反应供氧 B.能吸收鱼苗呼出的CO2气体
C.能使水体酸性增强 D.具有强氧化性,可杀菌灭藻
(6)将所得CaO2·8H2O晶体加热到150~160℃,完全脱水后得到过氧化钙样品。该小组测定过氧化钙样品中CaO2的纯度的方法是:准确称取0.4000g过氧化钙样品,400℃以上加热至完全分解成CaO和O2(设杂质不产生气体),得到33.60mL(已换算为标准状况)气体。则:所得过氧化钙样品中CaO2的纯度为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。下列叙述正确的是
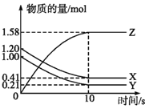
A.反应开始到10 s末时,用Z表示的反应速率为0.158 mol·L-1·s-1
B.反应开始到10 s末时,X的物质的量浓度减少了0.79 mol·L-1
C.反应开始到10 s时,Y的转化率为79.0%
D.反应的化学方程式为X(g)+Y(g)![]() Z(g)
Z(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列事实得出的结论正确的是( )。
选项 | 事实 | 结论 |
A | 甲、乙两种有机物具有相同的相对分子质量和不同的结构 | 甲和乙一定互为同分异构体 |
B | 质量相同的甲、乙两种有机物完全燃烧时产生质量相同的水 | 甲、乙两种分子中, |
C | 在淀粉溶液中加入稀硫酸,水浴加热一段时间后取出部分水解液,滴加银氨溶液后再加热,无银镜出现 | 淀粉的水解产物不具有还原性 |
D | 不存在两种邻二甲苯 | 苯分子中的碳碳键完全相同,苯不是单双键交替结构 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
A.SO2、SO3都是极性分子
B.在![]() 和[Cu(NH3)4]2+中都存在配位键
和[Cu(NH3)4]2+中都存在配位键
C.元素电负性越大的原子,吸引电子的能力越强
D.金刚石晶体中碳原子以共价键结合,具有键能大、熔点高、硬度大的特性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的有( )
①FeO投入稀H2SO4和稀HNO3中均得到浅绿色溶液
②向红砖粉末中加入盐酸,充分振荡反应后取上层清液于试管中,滴加KSCN溶液23滴,溶液呈红色,但不一定说明红砖中含有氧化铁
③Fe2O3![]() FeCl3(aq)
FeCl3(aq)![]() 无水FeCl3
无水FeCl3
④磁性氧化铁溶于稀硝酸的离子方程式为3Fe2++4H++NO3-=Fe3++NO↑+3H2O
⑤氢氧化铁与HI溶液反应的离子方程式为Fe(OH)3+H+=Fe3++3H2O
⑥Fe(OH)3不可用Fe2O3与水反应得到,但能通过其它化合反应制取
A.1个B.2个C.3个D.4个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、C、N、O元素是与生命活动密不可分的元素,请回答下列问题:
(1)“笑气”(N2O)是人类最早应用于医疗的麻醉剂之一。已知N2O分子中氧原子只与一个氮原子相连,则N2O的分子空间构型是________。
(2)另一种常用麻醉剂氯仿常因保存不慎而被氧化,产生剧毒物光气(COCl2):2CHCl3+O2=2HCl+2COCl2,光气(COCl2)分子的空间构型是________。
(3)维生素C是一种水溶性维生素,水果和蔬菜中含量丰富,该物质结构简式如图所示。以下关于维生素C的说法正确的是________(填字母序号)。
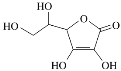
a.分子中既含有极性键又含有非极性键
b.1 mol分子中含有4 mol π键
c.该物质的熔点可能高于NaCl
d.分子中所含元素电负性由大到小的顺序为O>C>H
e.维生素C晶体溶于水的过程中要克服的微粒间作用力只有范德华力
(4)已知尿素的结构简式为H2NCONH2,尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3。
①基态Fe3+的核外电子排布式为____________。
C、N、O三种元素的第一电离能由大到小的顺序是________。
②尿素分子中C原子和N原子的杂化方式分别是__________。
③[Fe(H2NCONH2)6](NO3)3中H2NCONH2与Fe(+3价)之间的作用力称为__________,与![]() 互为等电子体的一种化合物分子是____________(写化学式)。
互为等电子体的一种化合物分子是____________(写化学式)。
(5)维生素B1可作为辅酶参与糖的代谢,并有保护神经系统的作用。该物质的结构简式为
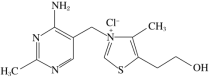
①以下关于维生素B1的说法正确的是________(填字母序号,下同)。
A.只含σ键和π键 B.既有共价键又有离子键
C.该物质的熔点可能高于NaCl D.该物质易溶于盐酸
②维生素B1晶体溶于水的过程中要克服的微粒间作用力有________。
A.离子键、共价键 B.离子键、氢键、共价键
C.氢键、范德华力 D.离子键、氢键、范德华力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜是一种用途广泛的化工原料,其化学式一般可表示为Cu(OH)2xCuCO3。某实验小组设计如下几个实验方案,测定碱式碳酸铜的组成,完成下列填空。
[方案一]用如图实验装置进行实验(夹持仪器省略),先通一段时间氮气,然后加热,加热完毕,再通一段时间氮气。
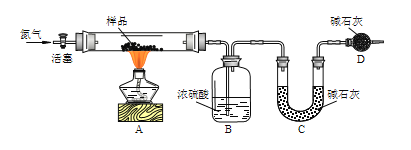
加热完毕再通一段时间氮气的作用是___。
若实验取14.200g样品,B装置增重0.900g,C装置增重3.300g,则x=___。
[方案二]用如图装置测定碱式碳酸铜与足量稀硫酸反应生成CO2的体积。
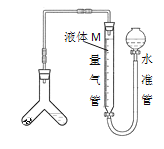
为了减小实验误差,量气管中液体M的选择原则是___。
通过实验,测得该试样中x值偏低,产生这种现象的原因可能是___
a.CO2气体中含有水蒸气
b.测定气体体积时未冷却至室温
c.Y型管中留有反应生成的气体
d.测定气体体积时水准管的液面高于量气管的液面
[方案三]该小组同学又用如下方案测定碱式碳酸铜的组成。
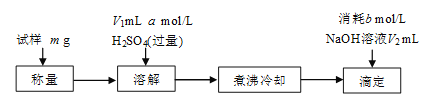
煮沸的目的主要是___。
若滴定时NaOH加入过量,则x值___(填“偏大”、“偏小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:
Ⅰ.先向B中的FeCl2溶液(约10mL)中通入Cl2,当B中溶液变黄时,停止通气。
Ⅱ.打开活塞b,使约2mL的溶液流入D试管中,检验取出溶液中的离子。
Ⅲ.接着再向B中通入一定量的SO2气体。
Ⅳ.更新试管D,重复过程Ⅱ,检验取出溶液中的离子。
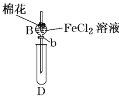
(1)棉花中浸润的溶液为____________,目的是____________________
(2)过程Ⅲ中一定发生反应的离子方程式为________________________________,过程Ⅳ中检验取出溶液中是否含有硫酸根的操作是______________________________________。
(3)该小组对SO2、Fe2+和Cl-还原性强弱比较期望达到的结论是___________________________。
(4)甲、乙、丙三同学分别完成了上述实验,下表是他们的检测结果,他们的检测结果一定能够证明SO2、Fe2+和Cl-还原性强弱关系的是______________。
过程Ⅱ中检出离子 | 过程Ⅳ中检出离子 | |
甲 | 有Fe3+无Fe2+ | 有SO42- |
乙 | 既有Fe3+又有Fe2+ | 有SO42- |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com