
����Ŀ������������һ�ְ�ɫ���壬������ˮ���������Ҵ�����ѧ����������������ơ�ijѧϰС������ڼ��Ի���������CaCl2��H2O2��Ӧ��ȡCaO2��8H2O��װ����ͼ��ʾ��
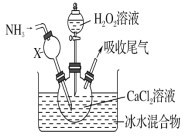
(1)С��ͬѧ��������֪����ʵ������������Ϊ20%��H2O2��Һ��Ϊ���ˡ�����H2O2��Һ����������Ϊ30%����С��ͬѧ������H2O2��Һ����Լ20%��H2O2��Һ�Ĺ����У�ʹ�õIJ�������������������ͷ�ι��⣬����_____________��
(2)�ڱ�ˮԡ�н��е�ԭ����_____________________��
(3)ʵ��ʱ����������ƿ������CaO2��8H2O���壬�ܷ�Ӧ�����ӷ���ʽΪ________________________��
(4)��CaCl2ԭ���к���Fe3+���ʣ�Fe3+���ֽ�H2O2����ʹH2O2�����������Խ��͡���Ӧ�Ļ���Ϊ��
�� Fe3+ + H2O2 = Fe2+ + H+ + HOO��
�� H2O2 + X = Y + Z + W(����ƽ)
�� Fe2+ +��OH = Fe3+ + OH-
�� H+ + OH- = H2O
�������������Ƶ�������еĻ�ѧ����ʽΪ___________________________��
(5)�������ƿ����ڳ�;�������磬�������˹������ƾ���_____________�����ʡ�
A.��ˮ������Ӧ���� B.���������������CO2����
C.��ʹˮ��������ǿ D.����ǿ�����ԣ���ɱ������
(6)������CaO2��8H2O������ȵ�150~160�棬��ȫ��ˮ��õ�����������Ʒ����С��ⶨ����������Ʒ��CaO2�Ĵ��ȵķ����ǣ�ȷ��ȡ0.4000g����������Ʒ��400�����ϼ�������ȫ�ֽ��CaO��O2(�����ʲ���������)���õ�33.60mL(�ѻ���Ϊ��״��)���塣�����ù���������Ʒ��CaO2�Ĵ���Ϊ_________��
���𰸡��ձ�����Ͳ ��ֹ�¶ȹ���H2O2�ֽ⡢�����ھ������� Ca2+ + H2O2 + 2NH3 + 8H2O=CaO2��8H2O�� + 2NH4+ HOO��+ H2O2=H2O + O2 +��OH ABD 54.00%
��������
��1������H2O2��Һ����������Ϊ30%�����Ƴ�20%��������Ͳ���ձ��ȣ�
��2����Ӧ�¶Ƚϵͣ��ɱ����������ֽ⣻
��3����ӦΪ����������������Ȼ��ƣ����ɹ������ƺ��Ȼ�泥�
��4�������������Ȼ�����������ˮ�������������̿�֪��Ӧ��Ӧ����������OH����HOO���뷴Ӧ��
��5���������ƾ���ǿ�����ԣ�������ɱ�����������ṩ������
��6���������������֪�������Ƶ���������������������ƴ��ȡ�
��1��������H2O2��Һ����Լ20%��H2O2��Һ�Ĺ����У�ʹ�õIJ�������������������ͷ�ι��⣬�����ձ�����Ͳ���ɸ�����Һ������������������ձ����ƣ��ʴ�Ϊ���ձ�����Ͳ��
��2����ˮԡ�ɷ�ֹ�¶ȹ���H2O2�ֽ⡢�����ھ����������ʴ�Ϊ����ֹ�¶ȹ���H2O2�ֽ⡢�����ھ���������
��3����ӦΪ����������������Ȼ��ƣ����ɹ������ƺ��Ȼ�泥����ӷ���ʽΪCa2++H2O2 +2NH3 +8H2O�TCaO28H2O��+2NH4+��
��4�������������Ȼ�����������ˮ�������������̿�֪��Ӧ��Ӧ����������OH����HOO���뷴Ӧ����Ӧ�ķ���ʽΪHOO+H2O2�TH2O+O2 +OH��
��5���������ƾ���ǿ�����ԣ�������ɱ����������ˮ��Ӧ�����������ƺ����������ṩ�������������ƿ����ն�����̼���ʴ�Ϊ��ABD��
��6���漰��ӦΪ![]() ���������������ʵ���Ϊ
���������������ʵ���Ϊ![]() =0.0015mol����n��CaO2��=0.003mol������Ϊ
=0.0015mol����n��CaO2��=0.003mol������Ϊ![]() =54.00%��
=54.00%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������з�����ͬ�ķ�Ӧ��A(g)+3B(g)![]() 2C(g)�����ݡ��Һ�ѹ���¶���ͬ���㶨����ʼʱ���м���0.01mol A��0.03mol B�����м���0.02mol C����ʼʱ������ѹǿ��ȣ����ֱ�ﵽƽ�⡣�����й�����ƽ��״̬��������ȷ����( )
2C(g)�����ݡ��Һ�ѹ���¶���ͬ���㶨����ʼʱ���м���0.01mol A��0.03mol B�����м���0.02mol C����ʼʱ������ѹǿ��ȣ����ֱ�ﵽƽ�⡣�����й�����ƽ��״̬��������ȷ����( )
A.���������С����B.C�����ʵ�������һ��С����
C.ѹǿ�����ܴ�����D.A��CŨ�ȱ�ֵ![]() ����һ��С����
����һ��С����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.���ݶ��������ɽ���ɢϵ��Ϊ��Һ����������Һ
B.�ñ���ʳ��ˮ���ˮ����ʯ��Ӧ�����Լ�����Ȳ�IJ�������
C.�Ʊ���������ʱ�����ȵ�NaOH��Һ�ռ������Գ�ȥ���е�����
D.ʵ���ҴӺ�����ȡ���ʵ�ķ����ǣ�ȡ��![]() ����
����![]() �ܽ�
�ܽ�![]() ����
����![]() ��ȡ
��ȡ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ������������������⾫�������ϵ����ƾ�ͭ������������:
![]()
��֪����ԭ����Ӧ�У������е�![]() ��ת��Ϊ
��ת��Ϊ![]() ��Ȼ��
��Ȼ��![]() ����
����![]() ��Ӧ���ɴ�ͭ������������ȷ���ǣ� ��
��Ӧ���ɴ�ͭ������������ȷ���ǣ� ��
A.����ͭ���նԻ����Ѻã��������������Ⱦ��
B.�������������У�![]() �������������ǻ�ԭ��
�������������ǻ�ԭ��
C.��![]() ����ԭ��ΪCu���ܷ�Ӧ�У�
����ԭ��ΪCu���ܷ�Ӧ�У�![]() ������
������
D.�������ʱ�������ȹ�������û������γ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����úֱ����Ϊȼ��ȼ�գ�������Ч�ʽϵͣ��Ҳ����̳���������������������ʣ�������صĻ�����Ⱦ��ú�ĸ��������ú�������ʡ�������Ҫ����ԭ�ϡ�������Ⱦ���ŷ�������Ч��ʩ֮һ��ij��ѧѧϰС����ʵ����������̽��ú����������װ����ͼ��ʾ����ش��й����⣺

��1��ú�����������___��
��2��ʢ����ˮ���ձ���������___��
��3��ʵ�������дְ�ˮ���ɵIJ�����___��
��4����֪CO����ʹ��ˮ��ɫ�������Ӿ�֧�Թ�֧�ܿڴ��ݳ�������ͨ����ˮ�У�������ˮ��ɫ����˵��ú�ĸ��������___��
��5����ú�����з���������ױ������ױ���ʵ�鷽����___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������е�SO2������������Ҫ��Ⱦ������о����������Ӿ���[N(CH3)4]2SO4(s)����SO2�������¿��淴Ӧ��ʹ����ܳ�Ϊ��ɫ��SO2���ռ���
[N(CH3)4]2SO4(s)+SO2(g)![]() [N(CH3)4]2S2O6(s)
[N(CH3)4]2S2O6(s)
����˵����ȷ����
A.[N(CH3)4]+��ֻ�����ۼ�
B.�÷�Ӧ�У�SO2��������
C.SO2Ư��Ʒ����������ǿ������
D.ÿ���ձ�״���µ�SO211.2L������15.4g[N(CH3)4]2S2O6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() Ϊ�����ӵ�������ֵ������˵����ȷ����
Ϊ�����ӵ�������ֵ������˵����ȷ����
A. 0.1 mol ��![]() ������
������![]() ������
������
B. pH=1��H3PO4��Һ�У�����![]() ��
��![]()
C. 2.24L����״��������O2����ȫȼ�գ��õ�![]() ��CO2����
��CO2����
D. �ܱ�������1 mol PCl3��1 mol Cl2��Ӧ�Ʊ� PCl5��g��������![]() ��P-Cl��
��P-Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.1 mol/L CH3COOH��Һ��ˮϡ�ͻ��������CH3COONa����ʱ����������( )
A. ��Һ��pH����
B. CH3COOH���������
C. ��Һ�ĵ�����������
D. ��Һ��c(OH��)��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ����
A.4.2g��ϩ�ͻ�����Ļ�����к�����ԭ�ӵ���ĿΪ0.6NA
B.0.2 mol��ϩȩ�к���˫������ĿΪ0.2NA
C.���³�ѹ�£�22.4 L��Ȳ�к��з��ӵ���ĿΪNA
D.��״���£�11.2 L�״��к��з��ӵ���ĿΪ0.5NA
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com