
【题目】一种以“火法粗炼”、“电解精炼”相结合的炼制精铜工艺流程如下:
![]()
已知“还原”反应中,冰钢中的![]() 先转化为
先转化为![]() ,然后
,然后![]() 再与
再与![]() 反应生成粗铜。下列叙述正确的是( )
反应生成粗铜。下列叙述正确的是( )
A.该炼铜工艺对环境友好,不会产生大气污染物
B.“焙烧”过程中,![]() 既是氧化剂又是还原剂
既是氧化剂又是还原剂
C.在![]() ”还原”为Cu的总反应中,
”还原”为Cu的总反应中,![]() 作催化剂
作催化剂
D.“电解”时,金、银等贵金属被置换出来形成阳极泥
科目:高中化学 来源: 题型:
【题目】根据下列实验能得出相应结论的是
选项 | 实验 | 结论 |
A | 常温下,测得0.1mol/LNaA溶液的pH小于0.1mol/L Na2CO3溶液的pH | 酸性:HA>H2CO3 |
B | 向含有淀粉的FeI2溶液中加入足量溴水,溶液变蓝色 | 还原性:I->Fe2+ |
C | 向饱和FeSO4溶液中加入CuS固体,测得溶液中c(Fe2+)不变 | Ksp(CuS)<Ksp(FeS) |
D | 向氨水中滴加少量AgNO3溶液,无沉淀生成 | Ag+与NH3·H2O能大量共存 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家以MoS2为催化剂,在不同电解质溶液中实现常温电催化合成氨,其反应历程与相对能量模拟计算结果如图。下列说法错误的是( )

A. Li2SO4溶液利于MoS2对N2的活化
B. 两种电解质溶液环境下从N2→NH3的焓变不同
C. MoS2(Li2SO4溶液)将反应决速步(*N2→*N2H)的能量降低
D. N2的活化是N≡N键的断裂与N—H键形成的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知pC=-lgc(B),室温下,某二元酸(H2A)中部分微粒的pC值随溶液pH值变化关系如图所示。下列说法错误的是( )

A.曲线a表示的微粒是H+
B.溶液中水的电离程度:m>n
C.pH=8时,溶液中,c(HA-)>c(H2A)
D.pH=1与pH=3时,H2A的浓度几乎相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们对苯的认识有一个不断深化的过程。已知分子式为![]() 的甲、乙两种物质的结构简式如图所示。
的甲、乙两种物质的结构简式如图所示。

(1)甲、乙的化学性质的区别为甲能___________________(填字母,下同),而乙能___________________。
A.被酸性![]() 溶液氧化
溶液氧化
B.与溴水发生加成反应
C.与氢气发生加成反应
(2)![]() 甲和
甲和![]() 乙分别与
乙分别与![]() 发生完全加成反应,甲消耗___________
发生完全加成反应,甲消耗___________![]()
![]() ,而乙消耗__________
,而乙消耗__________![]()
![]()
(3)![]() 还可能有另一种结构丙(如图所示),其二氯代物有___________________种。
还可能有另一种结构丙(如图所示),其二氯代物有___________________种。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中X是直流电源。Y烧杯中c、d为石墨棒,Z烧杯中e、f是质量相同的铜棒。接通电路后,发现d附近溶液显红色。

(1)①电源b极为________(填“正”“负”或“阴”“阳”,下同)极。
②Z烧杯中e为________极。
③连接Y、Z烧杯线路中,电子流动的方向是d________(填“→”或“←”)e。
(2)①写出Y烧杯中c极上的电极反应式:_______________________________
②写出Y烧杯中总反应的化学方程式:________________________________
③写出Z烧杯中e极上的电极反应式:_______________________________
(3)①电解2 min后,取出e、f,洗净、烘干、称量,质量差为1.28 g,在通电过程中,电路中通过的电子为______mol。
②若Y烧杯中溶液体积为500 mL(电解后体积可视为不变),电解反应的速率v(OH-)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙是一种白色固体,微溶于冷水,不溶于乙醇,化学性质与过氧化钠类似。某学习小组设计在碱性环境中利用CaCl2与H2O2反应制取CaO2·8H2O,装置如图所示:
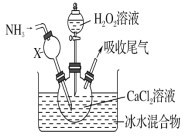
(1)小组同学查阅文献得知:该实验用质量分数为20%的H2O2溶液最为适宜。市售H2O2溶液的质量分数为30%。该小组同学用市售H2O2溶液配制约20%的H2O2溶液的过程中,使用的玻璃仪器除玻璃棒、胶头滴管外,还有_____________。
(2)在冰水浴中进行的原因是_____________________。
(3)实验时,在三颈烧瓶中析出CaO2·8H2O晶体,总反应的离子方程式为________________________。
(4)若CaCl2原料中含有Fe3+杂质,Fe3+催化分解H2O2,会使H2O2的利用率明显降低。反应的机理为:
① Fe3+ + H2O2 = Fe2+ + H+ + HOO·
② H2O2 + X = Y + Z + W(已配平)
③ Fe2+ +·OH = Fe3+ + OH-
④ H+ + OH- = H2O
根据上述机理推导步骤②中的化学方程式为___________________________。
(5)过氧化钙可用于长途运输鱼苗,这体现了过氧化钙具有_____________的性质。
A.与水缓慢反应供氧 B.能吸收鱼苗呼出的CO2气体
C.能使水体酸性增强 D.具有强氧化性,可杀菌灭藻
(6)将所得CaO2·8H2O晶体加热到150~160℃,完全脱水后得到过氧化钙样品。该小组测定过氧化钙样品中CaO2的纯度的方法是:准确称取0.4000g过氧化钙样品,400℃以上加热至完全分解成CaO和O2(设杂质不产生气体),得到33.60mL(已换算为标准状况)气体。则:所得过氧化钙样品中CaO2的纯度为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。工艺流程如下:
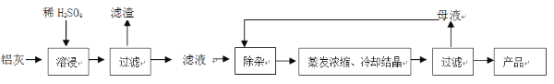
(一定条件下,![]() 可与Mn2+反应生成MnO2)
可与Mn2+反应生成MnO2)
已知: 生成氢氧化物沉淀的pH
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 3.4 | 6.3 | 2.7 |
完全沉淀时 | 5.2 | 9.7 | 3.2 |
(1)H2SO4溶解A12O3的离子方程式是_______________;
(2)检验滤液中还存在Fe2+的方法是____________(注明试剂、现象)。
(3)“除杂”环节有如下几个步骤:
(Ⅰ)向滤液中加入过量KMnO4溶液,调节溶液的pH为3.2;
(Ⅱ)加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
(Ⅲ)加入MnSO4至紫红色消失,过滤。
①步骤Ⅰ的目的_________;调节溶液的pH为3.2的目的是__________。
②向Ⅱ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是______,写出其反应方程式________________;
③Ⅲ中加入MnSO4的目的是__________。
(4)从多次循环使用后母液中可回收的主要物质是_________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列事实得出的结论正确的是( )。
选项 | 事实 | 结论 |
A | 甲、乙两种有机物具有相同的相对分子质量和不同的结构 | 甲和乙一定互为同分异构体 |
B | 质量相同的甲、乙两种有机物完全燃烧时产生质量相同的水 | 甲、乙两种分子中, |
C | 在淀粉溶液中加入稀硫酸,水浴加热一段时间后取出部分水解液,滴加银氨溶液后再加热,无银镜出现 | 淀粉的水解产物不具有还原性 |
D | 不存在两种邻二甲苯 | 苯分子中的碳碳键完全相同,苯不是单双键交替结构 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com