
【题目】大气中的SO2是造成酸雨的主要污染物。最新研究表明,离子晶体[N(CH3)4]2SO4(s)能与SO2进行如下可逆反应,使其可能成为绿色的SO2吸收剂:
[N(CH3)4]2SO4(s)+SO2(g)![]() [N(CH3)4]2S2O6(s)
[N(CH3)4]2S2O6(s)
下列说法正确的是
A.[N(CH3)4]+中只含共价键
B.该反应中,SO2作氧化剂
C.SO2漂白品红是利用其强氧化性
D.每吸收标准状况下的SO211.2L,生成15.4g[N(CH3)4]2S2O6
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)如图是N2(g)和H2(g)反应生成1 mol NH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:_______。
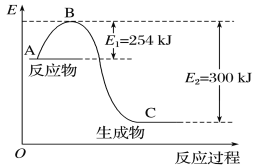
(2)若已知下列数据:
化学键 | H—H | N≡N |
键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N—H的键能:___kJ·mol-1。
(3)捕碳技术(主要指捕获CO2在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)=(NH4)2CO3(aq) ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)=NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3(aq) ΔH3
请回答下列问题:
ΔH3与ΔH1、ΔH2之间的关系是ΔH3=___。
(4)试比较下列两组△H的大小(填“>”、“<”或“=”)
①H2(g)+![]() O2(g)=H2O(g) △H1 H2(g)+
O2(g)=H2O(g) △H1 H2(g)+![]() O2(g)=H2O(l) △H2
O2(g)=H2O(l) △H2
则△H1____△H2
②S(s)+O2(g)=SO2(g) △H3
Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(s)+10H2O(l)+2NH3(g) △H4
则△H3______△H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知pC=-lgc(B),室温下,某二元酸(H2A)中部分微粒的pC值随溶液pH值变化关系如图所示。下列说法错误的是( )

A.曲线a表示的微粒是H+
B.溶液中水的电离程度:m>n
C.pH=8时,溶液中,c(HA-)>c(H2A)
D.pH=1与pH=3时,H2A的浓度几乎相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中X是直流电源。Y烧杯中c、d为石墨棒,Z烧杯中e、f是质量相同的铜棒。接通电路后,发现d附近溶液显红色。

(1)①电源b极为________(填“正”“负”或“阴”“阳”,下同)极。
②Z烧杯中e为________极。
③连接Y、Z烧杯线路中,电子流动的方向是d________(填“→”或“←”)e。
(2)①写出Y烧杯中c极上的电极反应式:_______________________________
②写出Y烧杯中总反应的化学方程式:________________________________
③写出Z烧杯中e极上的电极反应式:_______________________________
(3)①电解2 min后,取出e、f,洗净、烘干、称量,质量差为1.28 g,在通电过程中,电路中通过的电子为______mol。
②若Y烧杯中溶液体积为500 mL(电解后体积可视为不变),电解反应的速率v(OH-)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙是一种白色固体,微溶于冷水,不溶于乙醇,化学性质与过氧化钠类似。某学习小组设计在碱性环境中利用CaCl2与H2O2反应制取CaO2·8H2O,装置如图所示:
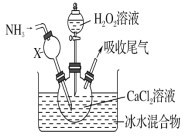
(1)小组同学查阅文献得知:该实验用质量分数为20%的H2O2溶液最为适宜。市售H2O2溶液的质量分数为30%。该小组同学用市售H2O2溶液配制约20%的H2O2溶液的过程中,使用的玻璃仪器除玻璃棒、胶头滴管外,还有_____________。
(2)在冰水浴中进行的原因是_____________________。
(3)实验时,在三颈烧瓶中析出CaO2·8H2O晶体,总反应的离子方程式为________________________。
(4)若CaCl2原料中含有Fe3+杂质,Fe3+催化分解H2O2,会使H2O2的利用率明显降低。反应的机理为:
① Fe3+ + H2O2 = Fe2+ + H+ + HOO·
② H2O2 + X = Y + Z + W(已配平)
③ Fe2+ +·OH = Fe3+ + OH-
④ H+ + OH- = H2O
根据上述机理推导步骤②中的化学方程式为___________________________。
(5)过氧化钙可用于长途运输鱼苗,这体现了过氧化钙具有_____________的性质。
A.与水缓慢反应供氧 B.能吸收鱼苗呼出的CO2气体
C.能使水体酸性增强 D.具有强氧化性,可杀菌灭藻
(6)将所得CaO2·8H2O晶体加热到150~160℃,完全脱水后得到过氧化钙样品。该小组测定过氧化钙样品中CaO2的纯度的方法是:准确称取0.4000g过氧化钙样品,400℃以上加热至完全分解成CaO和O2(设杂质不产生气体),得到33.60mL(已换算为标准状况)气体。则:所得过氧化钙样品中CaO2的纯度为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W,X,Y,Z的原子序数依次增加,由以上四种元素组成的一种化合物m在400℃完全分解,其反应式为3m![]() 4n+p+3q+6r,n能使湿润的红色石蕊试纸变蓝,q能用品红试液检验,下列说法正确的是( )
4n+p+3q+6r,n能使湿润的红色石蕊试纸变蓝,q能用品红试液检验,下列说法正确的是( )
A.原子半径:W<X<Y<Z
B.简单氢化物的稳定性X>Y>Z
C.W、X、Y形成的化合物抑制水的电离
D.m的分解产物中p为氧化产物,q为还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。工艺流程如下:
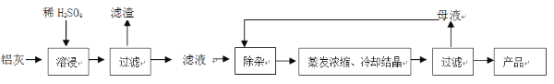
(一定条件下,![]() 可与Mn2+反应生成MnO2)
可与Mn2+反应生成MnO2)
已知: 生成氢氧化物沉淀的pH
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 3.4 | 6.3 | 2.7 |
完全沉淀时 | 5.2 | 9.7 | 3.2 |
(1)H2SO4溶解A12O3的离子方程式是_______________;
(2)检验滤液中还存在Fe2+的方法是____________(注明试剂、现象)。
(3)“除杂”环节有如下几个步骤:
(Ⅰ)向滤液中加入过量KMnO4溶液,调节溶液的pH为3.2;
(Ⅱ)加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
(Ⅲ)加入MnSO4至紫红色消失,过滤。
①步骤Ⅰ的目的_________;调节溶液的pH为3.2的目的是__________。
②向Ⅱ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是______,写出其反应方程式________________;
③Ⅲ中加入MnSO4的目的是__________。
(4)从多次循环使用后母液中可回收的主要物质是_________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是三种常见有机物的比例模型示意图.下列说法正确的是( )

A. 甲在光照条件下与Cl2反应可得到四种不同的产物
B. 乙、丙所有的原子均处于同一平面,均可使溴水反应褪色
C. 石油分馏可获得甲和乙,煤干馏可获得丙
D. 在浓硫酸存在下,丙与浓硝酸共热的反应属于取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的有( )
①FeO投入稀H2SO4和稀HNO3中均得到浅绿色溶液
②向红砖粉末中加入盐酸,充分振荡反应后取上层清液于试管中,滴加KSCN溶液23滴,溶液呈红色,但不一定说明红砖中含有氧化铁
③Fe2O3![]() FeCl3(aq)
FeCl3(aq)![]() 无水FeCl3
无水FeCl3
④磁性氧化铁溶于稀硝酸的离子方程式为3Fe2++4H++NO3-=Fe3++NO↑+3H2O
⑤氢氧化铁与HI溶液反应的离子方程式为Fe(OH)3+H+=Fe3++3H2O
⑥Fe(OH)3不可用Fe2O3与水反应得到,但能通过其它化合反应制取
A.1个B.2个C.3个D.4个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com