
常温下向四份0.1 mol·L-1的醋酸钠溶液中分别加入少量冰醋酸、硫酸氢钠固体、醋酸钠固体、氢氧化钠固体(忽略溶液体积及温度变化),则溶液中c(Ac-)/c(Na+)变化正确的是
A.增大、增大、不变、减小
B.增大、减小、增大、减小
C.减小、增大、增大、减小
D.增大、减小、不变、减小
B
【解析】
试题分析:在CH3COONa=CH3COO-+Na+。溶液中存在水解平衡:CH3COO-+H2O CH3COOH+OH-。所以c(Ac-)/c(Na+)<1.当向溶液中加入少量冰醋酸时,c(CH3COOH)增大,c(CH3COO-)增大,所以c(Ac-)/c(Na+)增大;当向溶液中加入少量硫酸氢钠固体时NaHSO4=Na++H++SO42-。电离产生的H+对水解平衡起促进作用,使c(CH3COO-)减小,所以c(Ac-)/c(Na+)减小;当向溶液中加入少量醋酸钠固体时,盐电离产生的CH3COO-使溶液中的c(CH3COO-)增大,c(Ac-)/c(Na+)增大;当向溶液中加入少量氢氧化钠固体时,NaOH=Na++OH-,c(OH-)增大,使水解平衡受到抑制,使c(CH3COO-)减小,所以c(Ac-)/c(Na+)减小。因此正确选项为B。
CH3COOH+OH-。所以c(Ac-)/c(Na+)<1.当向溶液中加入少量冰醋酸时,c(CH3COOH)增大,c(CH3COO-)增大,所以c(Ac-)/c(Na+)增大;当向溶液中加入少量硫酸氢钠固体时NaHSO4=Na++H++SO42-。电离产生的H+对水解平衡起促进作用,使c(CH3COO-)减小,所以c(Ac-)/c(Na+)减小;当向溶液中加入少量醋酸钠固体时,盐电离产生的CH3COO-使溶液中的c(CH3COO-)增大,c(Ac-)/c(Na+)增大;当向溶液中加入少量氢氧化钠固体时,NaOH=Na++OH-,c(OH-)增大,使水解平衡受到抑制,使c(CH3COO-)减小,所以c(Ac-)/c(Na+)减小。因此正确选项为B。
考点:考查外界条件对盐水解平衡的影响的知识。


科目:高中化学 来源: 题型:
(1)在①②两种溶液中各加入少量硫酸铵固体时,①②两种溶液的pH变化分别为①______________,②______________(填“增大”“减小”或“不变”)
(2)向等体积的①③两种溶液中逐滴加入稀硫酸,当恰好完全中和时,消耗稀硫酸的体积分别为V1、V2,则V1______V2(填“>”“<”或“=”)。此时,①所得溶液的pH=a,③所得溶液的pH=b,则恰好完全中和后①、③两种溶液中由水电离出的c(H+)之比为______________。
(3)若向①中加入稀硫酸至溶液的pH=7,此时c(![]() )=x mol·L-1,c(
)=x mol·L-1,c(![]() )=______________。此时消耗稀硫酸的体积______________V1(填“>”“<”或“=”)。
)=______________。此时消耗稀硫酸的体积______________V1(填“>”“<”或“=”)。
(4)将四份溶液稀释相同倍数后,溶液的pH:①____________④,②___________③(填“>”“<”或“=”)。
(5)在pH均为m的稀硫酸和硫酸铵溶液中,水电离产生的氢离子的物质的量浓度之比为:______________∶______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)
I.常温下浓度均为0.l mol/L的下列溶液:①Na2CO3溶液②NaHCO3溶液③盐酸④氨水
回答下列问题。
(1)上述溶液中有水解反应发生的是 (填编号,下同),溶液中溶质存在电离平衡的是 。
(2)四种溶液中对水的电离抑制作用最大的是 ;比较①、②溶液,pH较大的是 。
(3)在溶液④中加入NH4Cl固体,NH+4浓度与OH-浓度的比值将____(填“变大”、“变小”、“不变”)
II.有一瓶无色澄清溶渡,其中可能含有:NH+4、K+、Mg2+、Al3+、Fe2+、NO-3、Cl-、SO2-4、CO2-3取该溶液进行下列实验:
(1)取部分溶液,向其中逐滴滇入Ba(OH)2溶液至过量,有白色沉淀生成,沉淀量与加入Ba(OH)2溶液量的关系如右图所示。
(2)取(I)反应后过滤所得沉淀和滤液,在沉淀中加入稀盐酸后,沉淀不减少。将滤液分为两等份,一份加热,未产生刺激性气味的气体;另一份如HNO3酸化时有白色沉淀产生,继续加HNO3,沉淀又消失,再加AgNO3没有变化。
根据以上事实确定:该溶液中肯定存在的离子有 ;
肯定不存在的离子有____ 。
查看答案和解析>>
科目:高中化学 来源:2010年四川省南山中学高三上学期入学考试(理综)化学部分 题型:填空题
(14分)
I.常温下浓度均为0.l mol/L的下列溶液:①Na2CO3溶液②NaHCO3溶液③盐酸④氨水
回答下列问题。
(1)上述溶液中有水解反应发生的是 (填编号,下同),溶液中溶质存在电离平衡的是 。
(2)四种溶液中对水的电离抑制作用最大的是 ;比较①、②溶液,pH较大的是 。
(3)在溶液④中加入NH4Cl固体,NH+4浓度与OH-浓度的比值将____(填“变大”、“变小”、“不变”)
II.有一瓶无色澄清溶渡,其中可能含有:NH+4、K+、Mg2+、Al3+、Fe2+、NO-3、Cl-、SO2-4、CO2-3取该溶液进行下列实验:
(1)取部分溶液,向其中逐滴滇入Ba(OH
 )2溶液至过量,有白色沉淀生成,沉淀量与加入Ba(OH)2溶液量的关系如右图所示。
)2溶液至过量,有白色沉淀生成,沉淀量与加入Ba(OH)2溶液量的关系如右图所示。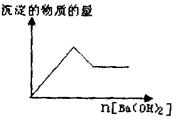
(2)取(I)反应后过滤所得沉淀和滤液,在沉淀中加入稀盐酸后,沉淀不减少。将滤液分为两等份,一份加热,未产生刺激性气味的气体;另一份如HNO3酸化时有白色沉淀产生,继续加HNO3,沉淀又消失,再加AgNO3没有变化。
根据以上事实确定:该溶液中肯定 存在的离子有 ;
存在的离子有 ;
肯定不存在的离子有____ 。
查看答案和解析>>
科目:高中化学 来源:2010年四川省高三上学期入学考试(理综)化学部分 题型:填空题
(14分)
I.常温下浓度均为0.l mol/L的下列溶液:①Na2CO3溶液②NaHCO3溶液③盐酸④氨水
回答下列问题。
(1)上述溶液中有水解反应发生的是 (填编号,下同),溶液中溶质存在电离平衡的是 。
(2)四种溶液中对水的电离抑制作用最大的是 ;比较①、②溶液,pH较大的是 。
(3)在溶液④中加入NH4Cl固体,NH+4浓度与OH-浓度的比值将____(填“变大”、“变小”、“不变”)
II.有一瓶无色澄清溶渡,其中可能含有:NH+4、K+、Mg2+、Al3+、Fe2+、NO-3、Cl-、SO2-4、CO2-3取该溶液进行下列实验:
(1)取部分溶液,向其中逐滴滇入Ba(OH)2溶液至过量,有白色沉淀生成,沉淀量与加入Ba(OH)2溶液量的关系如右图所示。

(2)取(I)反应后过滤所得沉淀和滤液,在沉淀中加入稀盐酸后,沉淀不减少。将滤液分为两等份,一份加热,未产生刺激性气味的气体;另一份如HNO3酸化时有白色沉淀产生,继续加HNO3,沉淀又消失,再加AgNO3没有变化。
根据以上事实确定:该溶液中肯定存在的离子有 ;
肯定不存在的离子有____ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com