
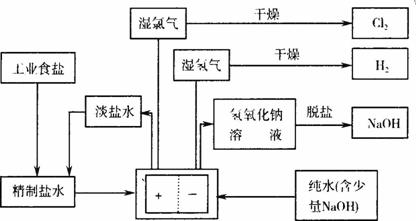
图10-7
依据图10-7完成下列填空:
(1)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过________、冷却、________(填写操作名称)除去NaCl。
(2)由图示可知用离子交换膜法电解制碱工艺中________产品可循环使用。
(3)已知NaCl在
(Ⅱ)在隔膜法电解食盐水(见图10-8)过程中,与电源正极相联的电极上所发生的反应为_________________________。
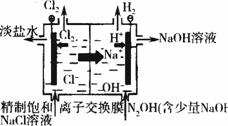
图10-8 离子交换膜法电解原理示意图
与电源负极相连的电极附近溶液的pH___________(填“升高”、“下降”或“不变”)。若采用无隔膜法电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为______________________。由隔膜法电解食盐水中离子交换膜的功能,进行大胆设想,能否用电解饱和Na2SO4溶液的方法生产NaOH和H2SO4?___________。若能,参照图10-8在方框内试画出装置示意图。

科目:高中化学 来源:2011-2012年湖南岳阳等四县一中高二第六次质检化学试卷(带解析) 题型:填空题
(10分)用规范的化学语言回答下列问题:
(1)过氧化钠跟CO2反应的化学方程式 。
(2)一定条件下,乙醛可跟氢气反应生成乙醇,该反应的反应类型是 。
(3)氯化铵溶液呈酸性的原因(用离子方程式回答) 。
(4)氢氧化镁浊液中的溶解沉淀平衡方程式 。
(5)氯碱工业中用电解饱和食盐水的方法制取烧碱和氯气,该电解过程中的电极反应方程式为:阳极 ,阴极 。
查看答案和解析>>
科目:高中化学 来源:2012年苏教版高中化学选修2 2.2氯碱生产练习卷(解析版) 题型:填空题
氯碱工业中用离子交换膜法电解制碱的主要生产流程示意图如下:
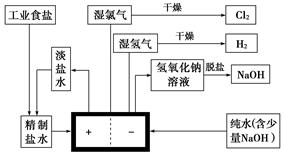
依据上图完成下列填空:
(1)与电源正极相连的电极上所发生反应的电极反应式为____________________;与电源负极相连的电极附近,溶液的pH________(填“不变”、“升高”或“降低”)。
(2)工业食盐含Ca2+、Mg2+、Fe3+等杂质,精制过程中发生反应的离子方程式为_________________________________________________________________________。
(3)如果粗盐中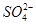 含量较高,必须添加钡试剂除去
含量较高,必须添加钡试剂除去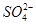 ,该钡试剂可以是________(填字母代号)。
,该钡试剂可以是________(填字母代号)。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)为有效除去Ca2+、Mg2+、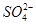 ,加入试剂的合理顺序为________(填字母代号)。
,加入试剂的合理顺序为________(填字母代号)。
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过______、冷却、______(填写操作名称)除去NaCl。
(6)由图示可知用离子交换膜法电解制碱工艺中________产品可循环使用。
(7)已知NaCl在60 ℃的溶解度为37.1 g,现电解60 ℃精制饱和食盐水1371 g,经分析,电解后溶液密度为1.37 g·cm-3,其中含有20 g NaCl,则电解后NaOH的物质的量浓度为________mol·L-1。
查看答案和解析>>
科目:高中化学 来源:2011-2012年湖南岳阳等四县一中高二第六次质检化学试卷(解析版) 题型:填空题
(10分)用规范的化学语言回答下列问题:
(1)过氧化钠跟CO2反应的化学方程式 。
(2)一定条件下,乙醛可跟氢气反应生成乙醇,该反应的反应类型是 。
(3)氯化铵溶液呈酸性的原因(用离子方程式回答) 。
(4)氢氧化镁浊液中的溶解沉淀平衡方程式 。
(5)氯碱工业中用电解饱和食盐水的方法制取烧碱和氯气,该电解过程中的电极反应方程式为:阳极 ,阴极 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A、氯碱生产的核心技术原理是电解原理
B、氯碱工业中用金属阳极代替石墨阳极是因为用金属阳极更节电且耐腐蚀,故使用寿命长
C、氯碱工业的产品应依据用户的需求量而定
D、氯碱生产的常用方法有离子膜法、隔膜法、水银法等,其中水银法制得的碱液纯度高、质量好,所以该法是氯碱工业的最理想的方法。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com