
| A. | Fe在少量Cl2中燃烧生成FeCl2 | |
| B. | 蛋白质的盐析和变性均是化学变化 | |
| C. | 化学反应的焓变与反应物和生成物的状态无关 | |
| D. | 按a、b两种途径由铜制备相同量的硝酸铜,途径a、b消耗的铜一样多 途径a:Cu$→_{△}^{O_{2}}$CuO$\stackrel{稀硝酸}{→}$Cu(NO3)2;途径b:Cu$\stackrel{稀硝酸}{→}$Cu(NO3)2 |
分析 A.氯气具有强氧化性,与铁反应生成氯化铁;
B.盐析为物理变化;
C.物质的能量与聚集状态有关;
D.根据质量守恒判断.
解答 解:A.Fe在少量Cl2中燃烧生成FeCl3,反应与量的多少无关,故A错误;
B.蛋白质的盐析是物理变化,变性是化学变化,故B错误;
C.化学反应的焓变与反应的途径无关,只与反应物和生成物的状态有关,故C错误;
D.由铜原子守恒可知,按a、b两种途径由铜制备相同量的硝酸铜,途径a、b消耗的铜一样多,故D正确.
故选D.
点评 本题考查较为综合,涉及物质的性质以及应用的考查,为高考常见题型,有利于培养学生良好的科学素养,提高学习的积极性,难度不大,注意相关基础知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | 硝化甘油在体内能够分解出NO,少量的NO会促进血管扩张,防止血管栓塞,因此,被广泛用于治疗心绞痛 | |
| B. | 侯氏制碱法的工艺流程应用了物质溶解度的差异 | |
| C. | 刚玉、红宝石、蓝宝石的主要成分是氧化铝,而青花瓷、石英玻璃、分子筛的主要成分是硅酸盐 | |
| D. | 生物炼铜法就是利用某种能耐受铜盐毒性的细菌,利用空气中的氧气把不溶性的硫化铜转化为可溶性的铜盐,从而使铜的冶炼变得成本低,污染小,反应条件十分简单 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 固体B2C3不能从溶液中制得 | |
| B. | C的氧化物对应水化物为强酸 | |
| C. | B的简单离子半径大于D的简单离子半径 | |
| D. | AD2分子中各原子最外层都达到8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3俗名纯碱,其水溶液显弱碱性 | |
| B. | 该溶液中K+、Al3+、SO42-可以大量共存 | |
| C. | 加水稀释该溶液,溶液中$\frac{c(HC{{O}_{3}}^{-})}{c(C{{O}_{3}}^{2-})}$增大 | |
| D. | 向该溶液中加入足量的氢氧化钙溶液的离子方程式为:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
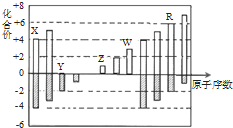
| A. | 原子半径:Z>Y>X | |
| B. | Z和Y形成的化合物是离子化合物 | |
| C. | 气态氢化物的稳定性:Y<R | |
| D. | 常温下单质W能溶于R的最高价氧化物对应水化物的浓溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| B. | AgCl溶于氨水:AgCl+2NH3•H2O=[Ag(NH3)2]++Clˉ+2H2O | |
| C. | 向NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO3 2- | |
| D. | 用稀硝酸除去试管内壁银:Ag+2H++NO3-=Ag++NO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为8、中子数为10的氧原子:${\;}_{8}^{10}$O | |
| B. | 氯离子的结构示意图: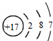 | |
| C. | 对苯二甲酸的结构简式: | |
| D. | NaHCO3在水溶液中的电离方程式:NaHCO3=Na++HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2的溶液中:K+、Mg2+、I-、S2- | |
| B. | Br-不能大量存在的溶液中:Fe2+、Ca2+、Cl-、NO3- | |
| C. | c(H+)=10-12mol•L-1的溶液中:Na+、Ba2+、NO3-、Cl- | |
| D. | 0.1 mol•L-1FeCl3溶液中:Mg2+、NH4+、SCN-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 SOCl2是一种重要的化学试剂,常用作有机合成的氯化剂;利用SOCl2与水剧烈反应的性质,常用于金属水合氯化物的脱水剂;SOCl2还可作电池的正极材料.
SOCl2是一种重要的化学试剂,常用作有机合成的氯化剂;利用SOCl2与水剧烈反应的性质,常用于金属水合氯化物的脱水剂;SOCl2还可作电池的正极材料.| SO3 | SCl2 | SOCl2 | SO2 | |
| 熔点 | 16.8℃ | -122℃ | -104.5℃ | -75.5℃ |
| 沸点 | 44.8℃ | 59℃ | 76℃ | -10℃ |
| 颜色 | 无色 | 樱桃红色 | 无色 | 无色 |
| 备注 | 不稳定 | 不稳定,沸点以上分解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com