
金晶体的最小重复单元(也称晶胞)是面心立方体,即在立方体的8个顶点各有一个金原子,各个面的中心有一个金原子,每个金原子被相邻的晶胞所共有。金原子的直径为d,用NA表示阿伏加德罗常数,M表示金的摩尔质量。

(1)金晶体每个晶胞中含有________个金原子。
(2)欲计算一个晶胞的体积,除假定金原子是刚性小球外,还应假定____________。
(3)一个晶胞的体积是__________。
(4)金晶体的密度是____________。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练3章物质聚集状态物质性质练习卷(解析版) 题型:选择题
干冰晶体是一种面心立方结构,如图所示,即每8个CO2构成立方体,且在6个面的中心各有1个,在每个CO2周围距离为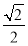 a(其中a为立方体棱长)的CO2有( )。
a(其中a为立方体棱长)的CO2有( )。
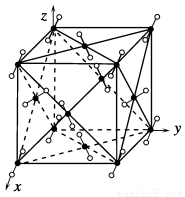
A.4个 B.8个 C.12个 D.6个
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练2.2.1典型分子空间构型练习卷(解析版) 题型:选择题
下列分子的空间构型可用sp2杂化轨道来解释的是( )。
①BF3;②CH2=CH2;③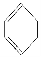 ;④CHCH;⑤NH3;⑥CH4
;④CHCH;⑤NH3;⑥CH4
A.①②③ B.①⑤⑥ C.②③④ D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练 3.3原子晶体与分子晶体练习卷(解析版) 题型:选择题
氮化硅是一种新合成的超硬、耐磨、耐高温的材料。下列对氮化硅的叙述中,正确的是( )。
A.氮化硅是分子晶体
B.氮化硅是原子晶体
C.氮化硅是离子晶体
D.氮化硅化学式为Si4N3
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练 3.2金属晶体与离子晶体练习卷(解析版) 题型:选择题
某固体仅由一种元素组成,其密度为5.0 g·cm-3。用X射线研究该固体的结构时得知:在边长为10-7 cm的正方体中含有20个原子,则此元素的相对原子质量最接近于下列数据中的( )。
A.32 B.120 C.150 D.180
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练 3.1认识晶体练习卷(解析版) 题型:选择题
将晶体划分为离子晶体、金属晶体、原子晶体和分子晶体的本质标准是( )。
A.基本构成微粒种类
B.晶体中最小重复结构单元的种类
C.微观粒子的密堆积种类
D.晶体内部微粒的种类及微粒间相互作用的种类
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练 2.1.2键参数练习卷(解析版) 题型:填空题
有A、B、C、D、E、F六种元素,已知:
①它们位于三个不同短周期,核电荷数依次增大。
②E元素的电离能数据见下表(kJ·mol-1):
I1 | I2 | I3 | I4 | … |
496 | 4 562 | 6 912 | 9 540 | … |
③B与F同主族。
④A、E分别都能与D按原子个数比1∶1或2∶1形成化合物。
⑤B、C分别都能与D按原子个数比1∶1或1∶2形成化合物。
(1)写出只含有A、B、D、E四种元素的两种无水盐的化学式________________、________________。
(2)B2A2分子中存在________个σ键,________个π键。
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练 1.3原子结构与元素性质练习卷(解析版) 题型:选择题
不能说明X的电负性比Y的电负性大的是( )。
A.与H2化合时X单质比Y单质容易
B.X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强
C.X原子的最外层电子数比Y原子最外层电子数多
D.X单质可以把Y从其氢化物中置换出来
查看答案和解析>>
科目:高中化学 来源:2014年高二化学苏教版选修2 6.2绿色化学与可持续发展练习卷(解析版) 题型:填空题
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
请回答下列问题:
(1)煤的气化的主要化学反应方程式为:______________________________________。
(2)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:____________________________________________________________。
(3)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)  CH3OH(g)ΔH=-90.8 kJ·mol-1
CH3OH(g)ΔH=-90.8 kJ·mol-1
②2CH3OH(g)  CH3OCH3(g)+H2O(g)ΔH=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g)ΔH=-23.5 kJ·mol-1
③CO(g)+H2O(g)  CO2(g)+H2(g)ΔH=-41.3 kJ·mol-1
CO2(g)+H2(g)ΔH=-41.3 kJ·mol-1
总反应3H2(g)+3CO(g)  CH3OCH3(g)+CO2(g)的ΔH=________;
CH3OCH3(g)+CO2(g)的ΔH=________;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是________(填字母代号)。
a.高温高压
b.加入催化剂
c.减少CO2的浓度
d.增加CO的浓度
e.分离出二甲醚
(4)已知反应②2CH3OH(g)??CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
①比较此时正、逆反应速率的大小:v正________v逆(填“>”、“<”或“=”)。
②若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH)=________;该时间内反应速率v(CH3OH)=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com