
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
请回答下列问题:
(1)煤的气化的主要化学反应方程式为:______________________________________。
(2)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:____________________________________________________________。
(3)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)  CH3OH(g)ΔH=-90.8 kJ·mol-1
CH3OH(g)ΔH=-90.8 kJ·mol-1
②2CH3OH(g)  CH3OCH3(g)+H2O(g)ΔH=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g)ΔH=-23.5 kJ·mol-1
③CO(g)+H2O(g)  CO2(g)+H2(g)ΔH=-41.3 kJ·mol-1
CO2(g)+H2(g)ΔH=-41.3 kJ·mol-1
总反应3H2(g)+3CO(g)  CH3OCH3(g)+CO2(g)的ΔH=________;
CH3OCH3(g)+CO2(g)的ΔH=________;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是________(填字母代号)。
a.高温高压
b.加入催化剂
c.减少CO2的浓度
d.增加CO的浓度
e.分离出二甲醚
(4)已知反应②2CH3OH(g)??CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
①比较此时正、逆反应速率的大小:v正________v逆(填“>”、“<”或“=”)。
②若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH)=________;该时间内反应速率v(CH3OH)=________。
(1)C+H2O(g)  CO+H2
CO+H2
(2)H2S+Na2CO3=NaHS+NaHCO3
(3)-246.4 kJ·mol-1 c、e
(4)①> ②0.04 mol·L-1 0.16 mol/(L·min)
【解析】(3)根据盖斯定律,①×2+②+③得总反应,总反应的ΔH=-90.8 kJ·mol-1×2+(-23.5 kJ·mol-1)+(-41.3 kJ·mol-1)=-246.4 kJ·mol-1
a项,该反应为放热反应,升高温度,平衡左移;b项,加催化剂平衡不移动;c项,减少生成物浓度,平衡右移;d项,增加CO浓度,平衡右移,但CO转化率减小;e项与c项原理相同。
(4)①该时刻浓度商Qc= =1.86,Qc小于平衡常数K,平衡向右移动,v正>v逆。
=1.86,Qc小于平衡常数K,平衡向右移动,v正>v逆。
②设从题干中这一时刻到平衡状态,CH3OCH3的物质的量浓度增加c。则
2CH3OH(g)  CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
某时刻: 0.44 0.6 0.6
继续反应: 2c c c
平衡状态:0.44-2c 0.6+c 0.6+c
平衡状态时,K= =400,
=400,
解得c=0.2 mol/L
c(CH3OH)=0.44 mol/L-2×0.2 mol/L=0.04 mol/L
反应前CH3OH的浓度为0.44 mol/L+0.6 mol/L×2=1.64 mol/L
该时间内的反应速率v(CH3OH)= =0.16 mol/(L·min)。
=0.16 mol/(L·min)。


科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练 3.1认识晶体练习卷(解析版) 题型:填空题
金晶体的最小重复单元(也称晶胞)是面心立方体,即在立方体的8个顶点各有一个金原子,各个面的中心有一个金原子,每个金原子被相邻的晶胞所共有。金原子的直径为d,用NA表示阿伏加德罗常数,M表示金的摩尔质量。

(1)金晶体每个晶胞中含有________个金原子。
(2)欲计算一个晶胞的体积,除假定金原子是刚性小球外,还应假定____________。
(3)一个晶胞的体积是__________。
(4)金晶体的密度是____________。
查看答案和解析>>
科目:高中化学 来源:2014年高二化学苏教版选修2 模块综合检测练习卷(解析版) 题型:填空题
工业上用粗氧化铜(含杂质FeO)为原料制取氯化铜晶体(CuCl2·2H2O)的生产流程如下:
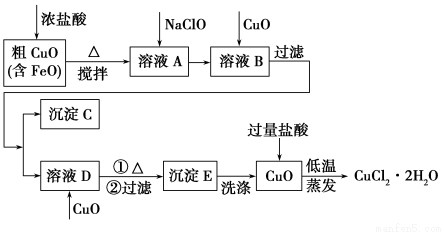
物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
完全沉淀时的pH | ≥9.6 | ≥6.4 | 3~4 |
(1)写出向溶液A中加入NaClO的离子方程式___________________________________。
(2)沉淀C的化学式为________。
(3)实验室如何检验沉淀E已洗涤干净?________。
(4)低温蒸发的目的是______________________________________。
(5)流程中两次加入了CuO,而不是一次性向溶液B中加入过量的CuO,其理由是________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高二化学苏教版选修2 6专题综合检测练习卷(解析版) 题型:选择题
工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下处理措施和方法正确的是( )。
选项污染物处理措施方法类别
A废酸加生石灰中和物理法
BCu2+等重金属离子加硫酸盐沉降化学法
C含苯废水用活性炭吸附物理法
D含纯碱的废水加石灰水反应化学法
查看答案和解析>>
科目:高中化学 来源:2014年高二化学苏教版选修2 6专题综合检测练习卷(解析版) 题型:选择题
农用地膜废弃后埋于地下,会阻碍土壤的透水、透气性,影响农作物的根系生长,从而导致明显减产。现研制出用玉米秸秆、小麦秆等经处理后生产出再生纤维,再将其与新型塑料混合制成一种新型农用地膜,该地膜可在不长时间内被降解。则下列有关叙述正确的是( )。
A.这种农用地膜中的可降解物的主要成分是(C6H10O5)n
B.这种农用地膜中的可降解物的主要成分是聚氯乙烯
C.这种农用地膜的废弃物应该烧掉,不应埋掉
D.若将普通农用地膜的废弃物浸于水中,不久便可降解
查看答案和解析>>
科目:高中化学 来源:2014年高二化学苏教版选修2 6.2绿色化学与可持续发展练习卷(解析版) 题型:选择题
“绿色化学”是21世纪化学发展的主导方向。“绿色化学”要求从根本上消除污染,是一门能彻底防止污染产生的科学,包括“绿色生成”和“绿色销毁”等内容。在整顿音像市场的活动中,查封了一批盗版光盘,并进行了“绿色销毁”。以下属于“绿色销毁”的是( )。
A.泼上汽油焚烧 B.倾倒于江河之中
C.深埋于土中 D.碾压粉碎后回收利用
查看答案和解析>>
科目:高中化学 来源:2014年高二化学苏教版选修2 6.1环境污染的化学防治练习卷(解析版) 题型:选择题
你认为减少酸雨产生的途径可采用的措施是( )。
①少用煤作燃料;②把工厂烟囱造高;③燃料脱硫;④在已酸化的土壤中加石灰;⑤开发新能源
A.①②③ B.②③④⑤ C.①③⑤ D.①③④⑤
查看答案和解析>>
科目:高中化学 来源:2014年高二化学苏教版选修2 5.4化学农药的发展练习卷(解析版) 题型:填空题
瑞士化学家米勒因合成DDT于1948年获得诺贝尔奖。在第二次世界大战中的1944年,美国在意大利的许多士兵因使用DDT来扑灭传染斑疹伤寒流行病人身上的虱子而避免丧生。联合国世界卫生组织曾评价说:“单独从疟疾病者,DDT可能拯救了5 000万生命。”但进一步的观察和研究表明,DDT是一种难降解的有毒化合物,进入人体内可引起慢性中毒。我国已于1983年停止生产和使用。
(1)杀虫剂“1605”本身对人畜毒性远强于DDT,但DDT已被禁用,而“1605”尚未禁用,这是为什么?________________________________________________________________。

由结构分析知:“1605”在使用过程中,不能与________物质混合使用,否则会因________。
(2)DDT可以用电石为原料经以下途径而制得:

①写出④⑤⑥步反应的化学方程式。
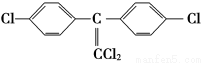
②DDT有毒性,国际上已禁止使用,因为它在动物体内转化为一种使动物生长失调的物质(结构简式如下)。在实验室也可实现这种转化,表示这种转化的化学方程式为____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高二化学苏教版选修2 4.3复合材料的制造练习卷(解析版) 题型:选择题
氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C=2AlN+3CO,下列叙述正确的是( )。
A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中每生成2 mol AlN,N2得到3 mol电子
C.氮化铝中氮元素的化合价为-3价
D.氮化铝属于复合材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com