
【题目】CuSO4、Fe2(SO4)3、H2SO4的混合溶液100 mL,已知溶液中阳离子的浓度相同,且SO42—的物质的量浓度为3 mol·L-1,则此溶液最多溶解铁粉的质量为
A. 5.6 g B. 11.2 g C. 22.4 g D. 33.6 g
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】某羧酸酯的分子式为C18H26O5,1mol该酯完全水解可得到1mol羧酸和2mol乙醇,该羧酸的分子式为
A.C14H18O5 B.C14H16O4 C.C14H22O5 D.C14H10O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. Cl- 和Cl2都有毒
B. 含Cl-的溶液和氯水一样均呈黄绿色
C. 将NaCl溶液滴入AgNO3溶液中或将氯气通入AgNO3溶液中均会出现白色沉淀
D. 漂白粉的主要成分为次氯酸钙,可用于消毒剂、水质净化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某pH=1的无色透明溶液中能大量共存的离子组是
A.Na+、NO3-、HCO3-、Cl-B.Al3+、SO42-、NH4+、Cl-
C.Fe2+、K+、SO42-、NO3-D.Cl-、Na+、S2O32-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有HCO3﹣、SO32﹣、Na+、CH3COO﹣等四种离子,向其中加入足量的Na2O2固体后,溶液中离子浓度基本保持不变的是(假设溶液体积不变)( )
A.CH3COO﹣B.SO32﹣C.Na+D.HCO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应①I2+SO2+2H2O═H2SO4+2HI,②2FeCl3+2HI═2FeCl2+2HCl+I2,判断下列离子的还原性由强到弱的顺序中,正确的是( )
A. SO2>I->Fe2+ B. Fe2+>SO2>I-
C. Fe2+>I->SO2 D. I->Fe2+>SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和热的测定实验中取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:
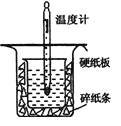
(1)从上图实验装置看,其中尚缺少的一种玻璃用品是__________,除此之外,装置中的一个明显错误是_____________。
(2)若改用60mL 0.25mol·L-1 H2SO4和50mL 0.55mol·L-1 NaOH溶液进行反应与上述实验相比,所放出的热量_______(填“相等”或“不相等”)
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | ||
H2SO4 | NaOH | 平均值 | ||
1 | 26.2 | 26.0 | 26.1 | 29.5 |
2 | 27.0 | 27.4 | 27.2 | 32.3 |
3 | 25.9 | 25.9 | 25.9 | 29.2 |
4 | 26.4 | 26.2 | 26.3 | 29.8 |
(3)近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃),通过以上数据计算中和热ΔH=_______( 结果保留小数点后一位)。
(4)上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)________。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是
A. 生成了一种强酸弱碱盐B. 弱酸溶液和强碱溶液反应
C. 强酸溶液和弱碱溶液反应D. 一元强酸溶液和一元强碱溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com