
��ͼ���漰������������Ԫ���У���һ��Ԫ���⣬�����Ϊ
1��18��Ԫ�أ���֪��A��FΪ��ɫ���嵥�ʣ�BΪ���д̼�����ζ�����壬CΪ��ɫ�����EΪ��ɫ��������(���ַ�Ӧ����δ��ȫ)��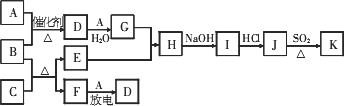
�ش��������⣺
(1)G�Ļ�ѧʽΪ________��
(2)д��B��C��Ӧ�Ļ�ѧ����ʽ________��
(3)J��K��ͬ�ֽ������Ȼ����KΪ��ɫ������д��SO2��ԭJ����K�����ӷ���ʽ��________________��
(4)����β���г�����D��B��D�ڼ��Ⱥʹ������ڵ������£�������Ӧ�������ֶԿ�������Ⱦ�����ʣ���д���÷�Ӧ�Ļ�ѧ����ʽ��________��
|
�����𰸣� (1)HNO3���� (2)3CuO��2NH3���� (3)2Cu2+��2Cl����SO2��2H2O����(4)6NO��4NH3 ������ʾ�����С� EΪ��ɫ�����������ǽ������嵥��A��F�ŵ�����D���Ⱦ�Ϊ�����ͻ�ƿڣ��Ƴ�A��D�����Ƴ�G��H����ͼ��H��K�ı仯�DZ�����ѵ㣬J��K�Ǵ��δѧ��֪ʶ����Ҫ��ϵ�(3)�������ʾ�Լ�������ԭ��Ӧ��֪ʶ���������� |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
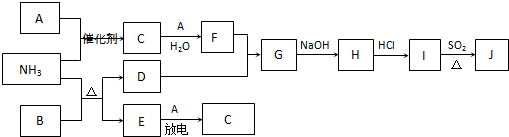
��Ŀ�����л�ѧ ��Դ�� ���ͣ�



| ||
| ||
�鿴�𰸺ͽ���>>
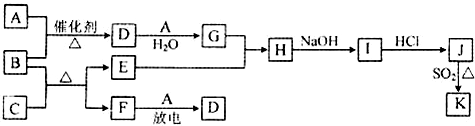
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
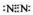
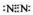
| ||
| �� |
| ||
| �� |
| ||
| ||
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ʱ��/s | 0 | 30 | 60 | 90 |
| n��L��/mol | 0.80 | a | b | c |
| n��M��/mol | 0.00 | 0.10 | 0.20 | 0.20 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com