
【题目】下列反应中,光照对反应几乎没有影响的是( )
A.氯气与氢气反应
B.次氯酸分解
C.甲烷与氯气反应
D.氢气与氮气反应
科目:高中化学 来源: 题型:
【题目】I.以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
①Zn为正极,Cu为负极
②H+向负极移动
③Cu极有H2产生
④电子流动方向Zn→Cu
⑤正极的电极反应式是Zn-2e-=Zn2+
⑥若有1mol电子流过导线,则理论上产生0.5 mol H2
(1)卡片中记录合理的是___________(填序号)
(2)该电池总反应的离子方程式是___________________________
(3)若将稀硫酸换成硫酸铜溶液,电极质量增加的是_____________ (填“锌极”或“铜极”)
Ⅱ.某温度时,在2 L密闭容器中,三种气态物质X、 Y、Z的物质的量(n)随时间(t)变化的曲线如右图所示,可得:
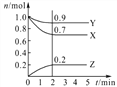
(1)该反应的化学方程式为_____________________
(2)反应开始至2 min,用Y表示的平均反应速率 为_______________
(3)在一定温度下,上述反应达到反应限度的标志的是____________
A. X、Y、Z的浓度相等
B. X、Y、Z的分子数比为3︰1︰2
C. Z的生成速率是Y的生成速率的二倍
D.单位时间内生成n mol Y,同时生成3n mol X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表揭示了许多元素的相似性和递变规律,下表中所示的一些元素。

(1)写出⑥元素的离子的核外电子排布示意图____________________。
(2)给④⑤⑥⑦⑧形成的单核离子的半径从大到小排序:_________(写离子符号)。
(3)给①②③④⑤⑥⑦⑧⑨的原子半径从大到小排序:__________(写原子符号)。
(4)给②⑥⑨最高价氧化物对应水化物碱性从大到小排序__________(写化学式)。
(5)给③④⑤的非金属性从大到小排序_________(写元素符号)。
(6)③是一种用途十分广泛的非金属,请写出③的最高价氧化物与过量的⑨的氢氧化物反应的化学方程式___________________________________。
(7)⑦号元素的氢氧化物有特殊的化学性质,写出⑦号元素的氯化物与足量的⑥号元素的氢氧化物反应的离子方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量CO2通入KOH和Ca(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(v)的关系正确的是( )
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,将Vml硫酸铜不饱和溶液蒸发a克水后析出b克CuSO4·5H2O晶体,剩余溶液再蒸发2a克水恰好全部变成C克CuSO4·5H2O晶体,则下列叙述正确的是( )
A. 原溶液中含有硫酸铜![]() (b + C)g B. 原溶液浓度为
(b + C)g B. 原溶液浓度为![]() mol/L
mol/L
C. 室温时硫酸铜溶解度为![]() g D. 原溶液的溶质质量分数为
g D. 原溶液的溶质质量分数为![]() %
%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验可获成功的是( )
A. 用乙烷和氯气等物质的量混合可以得到纯净的氯乙烷
B. 将稀硫酸和无水酒精按3:1的体积比混合加热到170℃制取乙烯
C. 将电石和饱和食盐水置于启普发生器中制取乙炔
D. 用酸性KMnO4溶液可将己烷和己烯二种无色液体鉴别开来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化铝(AlON)属原子晶体,是一种超强透明材料,下列描述错误的是
A. AlON和石英的化学键类型相同 B. AlON和石英晶体类型相同
C. AlON和Al2O3的化学键类型不同 D. AlON和Al2O3晶体类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲是ⅥA族元素,其单质和化合物在化工生产等方面具有广泛应用。
(1)TeO2是两性氧化物,微溶于水,可溶于强酸、或强碱。TeO2和NaOH溶液发生反应的化学方程式为______________。
(2)碲酸(H6TeO6)是一种很弱的酸,Ka1=1×10-7,该温度下0.1mol/L H6TeO6的电离度α为_____(结果保留一位有效数字)。在酸性介质中,碲酸可将HI氧化成I2,若反应生成的TeO2与Te的物质的量之比为1:1,试配平该化学方程式。_________
______HI+_____ H6TeO6=_____TeO2+_____Te+_____I2+_____H2O
(3)从粗铜精炼的阳极泥(主要含有Cu2Te)中提取粗碲的一种工艺流程如下:

① 已知加压酸浸时控制溶液的pH为5.0,生成TeO2沉淀。如果H2SO4溶液浓度过大,将导致TeO2沉淀不完全,原因是______________。
② 防止局部酸度过大的操作方法是_____________。
③ 对滤渣“酸浸”后,将Na2SO3加入Te(SO4)2溶液中进行“还原”得到固态碲,该反应的离子方程式是______________。
④ “还原”得到固态碲后分离出粗碲的方法_________,对粗碲进行洗涤,判断洗涤干净的实验操作和现象是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式 。
(2)写出NaClO3发生反应的主要离子方程式 ;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式 。
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为 。
(4)“操作1”中包含3个基本实验操作,它们依次是 、 和过滤。制得的CoCl2·6H2O在烘干时需减压烘干的原因是 。
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是 ;其使用的最佳pH范围是 。

A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是 。(答一条即可)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com