
【题目】一定条件下的可逆反应:2SO2(g)+O2(g)2SO3(g),若改变下列条件,可提高反应物中的活化分子百分数的是( )
A.升高温度
B.降低温度
C.增大压强
D.增大反应物浓度
科目:高中化学 来源: 题型:
【题目】根据下表中烃的分子式排布规律,判断空格中烃的同分异构体数目是
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
CH4 | C2H4 | C3H8 | C4H8 | C6H12 | C7H16 | C8H16 |
A. 3 B. 4 C. 5 D. 6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁铝是重要的轻金属,在日常生产、生活中应用广泛.
(1)镁燃烧不能用CO2灭火,用化学方程式表示其理由;
(2)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有 , 工业上利用此反应来焊接钢轨.
a.KCl b.KClO3 c.MnO2 d.Mg
取少量铝热反应所得的固体混合物,将其溶于足量稀硫酸,滴加KSCN溶液无明显现象,(填“能”或“不能”)说明固体混合物中无Fe2O3 , 理由是(用离子方程式说明)
(3)实验室中采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾(KAl(SO4)212H2O)的过程如图所示.回答下列问题: ![]()
(i)易拉罐溶解过程与试剂①反应的化学方程式为 .
(ii)沉淀B的化学式为;将少量明矾溶于水,溶液呈弱酸性,其原因是(用化学用语表示).
(iii)已知:Kw=1.0×10﹣14 , Al(OH)3AlO2﹣+H++H2O K=2.0×10﹣13 . Al(OH)3溶于NaOH溶液反应的平衡常数等于 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象所对应的离子方程式不正确的是( )
实 验 | 现 象 | 离子方程式 | |
A |
| 在空气中放置一段时间后,溶液呈蓝色 | 4H++4I﹣+O2═2I2+2H2O |
B |
| 溶液由浅绿色变为红色 | 2Fe2++Cl2═2Fe3++2Cl﹣、 |
C |
| 溶液由黄绿色变为无色 | Cl2+2OH﹣═Cl﹣+ClO﹣+H2O |
D |
| 有白色沉淀生成,溶液由红色变为无色 | Ba2++OH﹣+H++SO |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将X气体通入Y溶液中,实验结果与预测的现象一致的组合是( )
X气体 | Y溶液 | 预测的现象 |
| |
① | CO2 | 饱和Na2CO3溶液 | 白色沉淀析出 | |
② | SO2 | Ba(NO3)2溶液 | 白色沉淀析出 | |
③ | Cl2 | AgNO3溶液 | 白色沉淀析出 | |
④ | NH3 | AlCl3溶液 | 白色沉淀析出 |
A.只有①②③
B.只有①②④
C.只有①③④
D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向25mL18.4mol/LH2SO4溶液中加入足量的铜片并加热,充分反应后,被还原的H2SO4的物质的量( )
A.小于0.23mol
B.等于0.23mol
C.0.23mol~0.46mol之间
D.等于0.46mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知海水略呈碱性,钢铁在其中易发生电化腐蚀,有关说法正确的是( )
A.腐蚀时电子从碳转移到铁
B.在钢铁上连接铅块可起到防护作用
C.正极反应为O2+2H2O+4e﹣=4OH﹣
D.钢铁在淡水中易发生析氢腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( ) 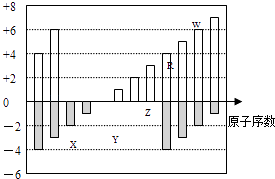
A.原子半径:Z>Y>X
B.气态氢化物的稳定性:R>W
C.WX3和水反应形成的化合物是离子化合物
D.Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com