
| A.①③ |
| B.②⑥ |
| C.④⑤ |
| D.③⑦ |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
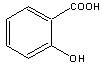 + (CH3CO)2O
+ (CH3CO)2O 
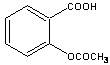 + CH3COOH
+ CH3COOH查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用稀硫酸洗掉钢铁表面的铁锈 |
| B.混有少量Fe粉的Cu粉中,加入足量稀盐酸,充分反应后过滤 |
| C.向KCl和MnO2(不溶于水)的混合物加入足量水溶解,过滤除去MnO2 |
| D.将混有少量CuCl2的FeCl2晶体,加入足量水溶解,过滤 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.使硫酸过量 |
| B.使铁屑过量 |
| C.使用稀H2SO4 |
| D.使用浓H2SO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.为提高SO2的转化率,接触室内反应温度选定在400℃~500℃ |
| B.为防止催化剂中毒,炉气在进入接触室之前需要净化 |
| C.为防止污染大气,从吸收塔出来的尾气常用NaOH溶液吸收 |
| D.为提高SO3的吸收效率,用稀硫酸代替水吸收SO3 . |
查看答案和解析>>
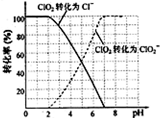
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
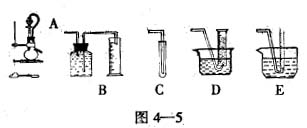
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象 |
| B.向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸 |
| C.实验时加热试管a的目的是及时将乙酸乙酯蒸出并加快反应速率 |
| D.试管b中Na2CO3的作用是除去随乙酸乙酯蒸出的少量乙酸和乙醇,降低乙酸乙酯在溶液中溶解度 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com