
【题目】钴和锌是重要的有色金属,其单质及化合物被广泛用于国民经济各个领域。一种从有机废催化剂中回收钴和锌的工艺流程如下:
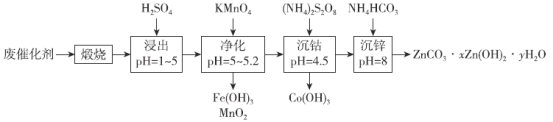
已知:“浸出”后溶液中含有Co2+、Zn2+、Mn2+、Fe2+、Fe3+等。请回答:
(1)“煅烧”的目的为______________________________。
(2)“净化”时,与KMnO4发生反应的所有离子方程式有_____________________________。
(3)“沉钴”时,发生如下反应:(NH4)2S2O8+H2O→NH4HSO4+H2O2;H2O2→H2O+O;···········;Co3++H2O→Co(OH)3+H+。所缺的化学方程式为______________________________;每生成1 molCo(OH)3,理论上消耗(NH4)2S2O8的物质的量为__________。
(4)Co(OH)3沉淀应依次用稀硫酸和水洗涤,检验沉淀是否洗涤干净的方法是____________。
(5)“沉钴”时pH不能太高,其原因为______________________________;“沉锌”时温度不能太高,其原因为________________________________________。
(6)取“沉锌”后所得固体34.1g,煅烧后得到固体24.3g,将生成的气体通过足量的浓硫酸,增重5.4g。则所得固体的化学式为____________。
【答案】除去其中的有机物(或将金属元素转化为氧化物,有利于后续浸出,合理即可) MnO4-+3Fe2++7H2O=MnO2↓+3Fe(OH)3↓+5H+、3Mn2++2MnO4-+2H2O=5MnO2↓+4H+ 2Co2++O+2H+=2Co3++H2O 0.5mol 取最后一次洗涤液少许于试管中,向其加入氯化钡溶液,没有白色沉淀生成,证明洗涤干净 防止Zn2+提前沉淀 防止NH4HCO3热分解 ZnCO32Zn(OH)2H2O
【解析】
将废催化剂高温煅烧,将有机废催化剂中的有机物除去,并将金属元素转化为金属氧化物,用硫酸对煅烧产物进行酸浸,pH控制在1~5,得到含有Co2+、Zn2+、Mn2+、Fe2+、Fe3+的浸出液,调节溶液pH值为5~5.2,加入高锰酸钾将Mn2+、Fe2+氧化并转化为Fe(OH)3和MnO2除去,再次调节溶液pH值为4.5,加入(NH4)2S2O8将Co2+氧化为Co3+并转化为Co(OH)3沉淀除去,调节pH值为8,加入碳酸氢铵使锌离子转化为ZnCO3xZn(OH)2yH2O沉淀,据此分析解答。
(1)“煅烧”可以除去其中的有机物,同时可将金属元素转化为金属氧化物,有利于后续浸出;
(2)“净化”时,加入KMnO4的目的是除去溶液中的Fe2+和Mn2+,反应的离子方程式为:MnO4-+3Fe2+ +7H2O= MnO2↓+3Fe(OH)3↓+5H+、3Mn2++2MnO4-+2H2O=5MnO2↓+4H+;
(3)从流程中可以看出,“沉钴”时,(NH4)2S2O8为氧化剂,因此除去的是Co2+,结合所给反应过程,缺少将Co2+转化为Co3+的反应,则可得所缺的化学方程式为2Co2++O+2H+=2Co3++H2O;根据电荷守恒可得,(NH4)2S2O8~H2O2~O~2Co3+~ 2Co(OH)3,每生成1mol Co(OH)3理论上消耗(NH4)2S2O8的物质的量为0.5mol;
(4) Co(OH)3沉淀应依次用稀硫酸和水洗涤,检验Co(OH)3沉淀是否洗涤干净,也就是检验是否含有硫酸根离子,可取取最后一次洗涤液少许于试管中,向其加入氯化钡溶液,没有白色沉淀生成,证明洗涤干净;
(5)“沉钴”时pH不能太高,防止Zn2+提前沉淀;“沉锌”时,加入NH4HCO3,铵盐受热易分解,温度不能太高,防止NH4HCO3热分解;
(6)取“沉锌”后所得固体34.1g,煅烧后得到固体24.3g,将生成的气体通过足量的浓硫酸,增重5.4g,增重的质量为水,根据质量守恒,煅烧生成的CO2气体的物质的量为![]() =0.1mol,根据元素守恒可知ZnCO3xZn(OH)2yH2O为0.1mol,煅烧后生成的ZnO的物质的量为
=0.1mol,根据元素守恒可知ZnCO3xZn(OH)2yH2O为0.1mol,煅烧后生成的ZnO的物质的量为![]() =0.3mol,根据Zn元素守恒,0.1mol+0.1molx=0.3mol,则x=2,生成水的物质的量为
=0.3mol,根据Zn元素守恒,0.1mol+0.1molx=0.3mol,则x=2,生成水的物质的量为![]() =0.3mol,根据氢元素守恒,0.1mol×2×2+0.1mol×2y=0.3mol×2,则y=1,则所得固体的化学式为ZnCO32Zn(OH)2H2O。
=0.3mol,根据氢元素守恒,0.1mol×2×2+0.1mol×2y=0.3mol×2,则y=1,则所得固体的化学式为ZnCO32Zn(OH)2H2O。


科目:高中化学 来源: 题型:
【题目】按要求填写:
(1) 我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭按照一定比例混合而成的,爆炸时的化学反应为:S+2KNO3+3C=K2S+N2↑+3CO2↑。该反应中氧化剂是_____,还原剂是______,_____元素被氧化,每生成6.72LCO2(标准状况下)气体需要__g硫参加反应,并用双线桥法来表示电子转移的方向和数目:______。
(2)铁是人类较早使用的金属之一。
①鉴别![]() 胶体和
胶体和![]() 溶液的常用方法是_____,两者本质区别是_____ 。
溶液的常用方法是_____,两者本质区别是_____ 。
②电子工业中用![]() 溶液腐蚀敷在绝缘板上的铜生产氯化亚铁和氯化铜,制造印刷电路板,请写出
溶液腐蚀敷在绝缘板上的铜生产氯化亚铁和氯化铜,制造印刷电路板,请写出![]() 溶液与铜反应的离子方程式______。
溶液与铜反应的离子方程式______。
③![]() 胶体制备实验:
胶体制备实验:
实验步骤:取一个小烧杯,加入25mL蒸馏水。将烧杯中的蒸馏水加热至沸腾,向沸水中逐滴加入5~6滴FeCl3饱和溶液。继续煮沸。
实验现象:烧杯中溶液呈_____色;化学方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(![]() )是最简单的一种。下列关于该化合物的说法错误的是
)是最简单的一种。下列关于该化合物的说法错误的是
A. 与环戊烯互为同分异构体
B. 二氯代物超过两种
C. 所有碳原子均处同一平面
D. 生成1 molC5H12至少需要2 molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E的+1价阳离子的核外有3层电子且各层均处于全满状态。
(1)E元素基态原子的核外电子排布式为________________。
(2)B、C、D三种元素的第一电离能由小到大的顺序为_______(填元素符号),其原因是___________________________。
(3)B2A4是石油炼制的重要产物之一 。B2A4分子中B原子轨道的杂化类型为________;1 mol B2A2分子中含________mol σ键。
(4)已知D、E能形成晶胞结构如图所示的两种化合物,则化学式:甲为_____,乙为______;高温时,甲易转化为乙的原因为__________________________。
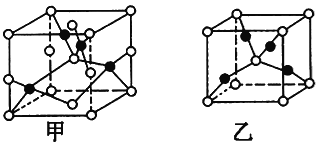
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铃兰吡喃(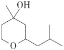 )常用于日用香精的调配,且合成简单和环保。其中一种生产工艺如下:
)常用于日用香精的调配,且合成简单和环保。其中一种生产工艺如下:
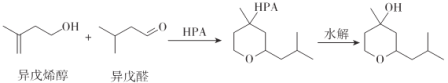
下列说法正确的是
A.铃兰吡喃的分子式为C10H18O2
B.异戊烯醇可发生氧化反应、加成反应和取代反应
C.异戊醛中所有碳原子可能共平面
D.铃兰吡喃的一氯代物有10种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍及其化合物在工农业生产中有着广泛应用,回答下列问题:
(1)基态镍原子的价电子排布式为________________;元素镍的第二电离能比铜小,其原因为__________________________________________________。
(2)Ni2+的检验可通过如下反应进行:
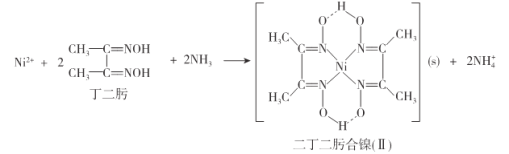
①二肟中碳原子的杂化轨道类型为__________。
②二丁二肟合镍(II)中存在的作用力有____________(填选项字母)。
a.σ键 b.π键 c.配位键 d.氢键
(3)Ni(CO)4可通过如下反应合成:NiS+5CO+4OH-→Ni(CO)4+S2-+CO32-+2H2O。反应中涉及所有元素的电负性由大到小的顺序为__________;与CO32-互为等电子体的分子有__________(任写2种)。
(4)Ni与As组成的某种化合物的晶体结构如图所示。
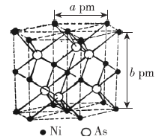
①每个Ni原子周围相邻的As原子有__________个。
②该化合物的化学式为__________,晶体密度为__________g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E是周期表中前四周期原子序数依次增大的五种元素。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同。D原子有2个未成对电子。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体。含E元素的硫酸盐溶液是制备波尔多液的原料之一。按要求回答下列问题:
(1)五种元素中第一电离能最大的是__________,电负性最大的是__________。(以上两空均填元素名称)
(2)基态E原子的价电子排布式为__________;E元素所在周期中基态原子的成单电子数最多的元素是__________(填元素符号)
(3)M分子中B原子的轨道杂化类型为__________,M分子中两种键角的大小关系是__________。(用∠XYZ表示,X、Y、Z代表元素符号)
(4)C3-的空间构型为__________;化合物CA3的沸点比BA4的高,其主要原因是__________。
(5)向E元素的硫酸盐溶液中通入过量的CA3,得到深蓝色的透明溶液,在此溶液中加入乙醇,析出深蓝色的晶体,此晶体中存在的化学键类型有__________。(填代号)
A.离子键 B.σ键 C.非极性共价健 D.配位键 E.金属键 F.氢键
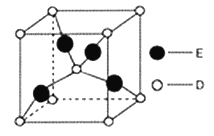
(6)如图是D、E两种元素形成的化合物的晶胞结构示意图,D的配位数为__________。已知晶胞中最近两个D原子间距离为anm,阿伏伽德罗常数用NA表示,则该晶体的密度为__________g/cm3(用含a、NA的表达式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正丁醛经催化加氢可制备1-丁醇。为提纯含少量正丁醛杂质的1-丁醇,现设计如下路线:
![]()
已知:①正丁醛与饱和NaHSO3溶液反应可生成沉淀;②乙醚的沸点是34℃,难溶于水,与1-丁醇互溶;③1-丁醇的沸点是118℃。则操作1~4分别是( )
A. 萃取、过滤、蒸馏、蒸馏 B. 过滤、分液、蒸馏、萃取
C. 过滤、蒸馏、过滤、蒸馏 D. 过滤、分液、过滤、蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积的硫酸铝、硫酸锌、硫酸钠溶液分别与足量氯化钡溶液反应,若生成硫酸钡沉淀的质量比为1∶2∶3,则三种硫酸盐的物质的量浓度之比为( )
A. 1∶2∶3B. 1∶6∶9C. 1∶3∶3D. 1∶3∶6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com