
【题目】下列离子方程式正确的是
A. 加热TiCl4浓溶液制备TiO2·xH2O:Ti4++(x+2)H2O![]() TiO2·xH2O+4H+
TiO2·xH2O+4H+
B. (NH4)2Fe(SO4)2溶液中加入少量KOH溶液:![]()
C. 钢铁发生吸氧腐蚀时的正极反应:O2+4H++4e-=2H2O
D. 酸性KI溶液中通入O2:4H++2I-+O2=2H2O+I2
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,可用废镍催化剂(主要含Ni、A1,少量Cr、FeS等)来制备,其工艺流程如下:

回答下列问题:
(1)“浸泡除铝”时,发生反应的化学方程式为________________。
(2)“溶解”时放出的气体为_________(填化学式)。
(3)“氧化1”时,酸性条件下,溶液中的Fe2+被氧化为Fe3+,其离子方程式为______________。
(4)己知该条件下金属离子开始沉淀和完全沉淀的pH如下表:
开始沉淀的pH | 完全沉淀的pH | |
Ni2+ | 6.2 | 8.6 |
Fe2+ | 7.6 | 9.1 |
Fe3+ | 2.3 | 3.3 |
Cr3+ | 4.5 | 5.6 |
“调pH 1”时,溶液pH范围为__________;过滤2所得滤渣的成分为___________(填化学式)。
(5)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式______________。
(6)若加热不充分,则制得的NiOOH中会混有Ni(OH)2,其组成可表示为xNiOOH·y Ni(OH)2。现称取8.29g xNiOOH·y Ni(OH)2样品溶于稀硫酸,搅拌至溶液澄清,定容至200mL,从中移取20.00 mL,用0.010mol·L-1的KMnO4标准溶液滴定,重复上述操作2次,平均消耗KMnO4 标准溶液 20.00 mL。已知 5Ni2++MnO4-+8H+=5Ni3++Mn2++4H2O,则x=_________,y=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作不正确的是
A. 用量筒量取25 mL蒸馏水 B. 用分液漏斗分离乙醇和水
C. 用烧杯溶解FeCl3试样 D. 用托盘天平称量NaCl固体5.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙微溶于水,溶于酸,可作分析试剂、医用防腐剂、消毒剂。以下是一种制备过氧化钙的实验方法。回答下列问题:
(一)碳酸钙的制备

(1)步骤①加入氨水的目的是_______。小火煮沸的作用是使沉淀颗粒长大,有利于____。
(2)下图是某学生的过滤操作示意图,其操作不规范的是______(填标号)。

a.漏斗末端颈尖未紧靠烧杯壁
b.玻璃棒用作引流
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
(二)过氧化钙的制备

(3)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈____性(填“酸”、“碱”或“中”)。将溶液煮沸,趁热过滤。将溶液煮沸的作用是___________。
(4)步骤③中反应的化学方程式为________,该反应需要在冰浴下进行,原因是_________。
(5)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是_______。
(6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。该工艺方法的优点是______,产品的缺点是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃时,Ksp[Mg(OH)2]=2.0×10-11,Ksp[Mn(OH)2]=2.0×10-13。该温度下,关于含有Mg(OH)2和Mn(OH)2两种固体的悬浊液,下列说法正确的是
A. 溶液中的![]()
B. 若加入少量NaOH,Ksp[Mg(OH)2]和Ksp[Mn(OH)2]均减小
C. 若加入少量MgCl2,溶液中的c(Mg2+)和c(Mn2+)均增大
D. 若升高温度,Mg(OH)2和Mn(OH)2两种固体的质量均不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,NH3·H2O的电离平衡常数Kb=1.75×10-5。该温度下,用0.01mol·L-1盐酸滴定10mLamol·L-1氨水,盐酸的体积V(HCl)与溶液的pH关系如图所示。下列说法正确的是
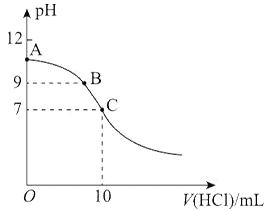
A. A点溶液中加少量水,![]() 减小
减小
B. 原氨水的物质的量浓度约为1.006×10-2mol·L-1
C. A、B、C三点溶液中水电离出来的c(OH-):A>B>C
D. C点时,盐酸和氨水恰好完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是( )
A. 2.24LCO2中含有的原子数为0.3 ×6.02×1023
B. 0.1L3 mol·L-1的NH4NO3溶液中含有的NH4+数目为0.3 ×6.02×1023
C. 5.6g铁粉与硝酸反应失去的电子数一定为0.3 ×6.02×1023
D. 4.5 SiO2晶体中含有的硅氧键数目为0.3 ×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硅的叙述中,正确的是( )
A.硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有元素中居第一位
B.硅的化学性质不活泼,在常温下不与任何物质反应
C.硅在电子工业中是最重要的半导体材料
D.硅的性质很稳定,能以单质的形式存在于自然界中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2溶于水所得溶液的性质为( )
A.有氧化性,无还原性,无酸性
B.无氧化性,有还原性,无酸性
C.有氧化性,有还原性,有酸性
D.无氧化性,有还原性,有酸性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com