
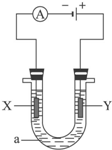
 ���ԭ���ڻ�ѧ��ҵ���й㷺Ӧ�ã���ͼ��ʾһ�����أ�װ�е��Һa��X��Y������缫�壬ͨ��������ֱ����Դ������������������⣺
���ԭ���ڻ�ѧ��ҵ���й㷺Ӧ�ã���ͼ��ʾһ�����أ�װ�е��Һa��X��Y������缫�壬ͨ��������ֱ����Դ������������������⣺
| ||
| ||


 ��Уͨ��֤��Ч��ҵϵ�д�
��Уͨ��֤��Ч��ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ʯ��ʯ��CaCO3�������ᷴӦ��CO2��CO32-+2H+=H2O+CO2�� |
| B����FeCl3��Һ�ܽⵥ��Fe��Fe3++Fe=2Fe2+ |
| C��������������Һ����������Cl2+2OH-=Cl-+ClO-+H2O |
| D��AlCl3��Һ�백ˮ����������ϣ�Al3++4NH3�qH2O=AlO2-+4NH4++2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��22.4LNe����NA��Ne���� |
| B��0.1mol/LNa2SO4��Һ����0.2NA��Na+ |
| C��25�棬1������ѹ�£�22gCO2�к���0.5NA��������̼���� |
| D����״���£�NA��ˮ������ռ�����ԼΪ22.4L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
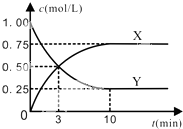 ��һ���¡������ܱ������г���1mol CO2��3mol H2��һ�������·�����Ӧ��
��һ���¡������ܱ������г���1mol CO2��3mol H2��һ�������·�����Ӧ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���ɢ�ʽ��֪H2��ȼ����Ϊ241.8KJ/mol |
| B��2H2��g��+O2��g���T2H2O��l����H��-483.6kJ/mol |
| C������1mol NaOH��ϡ��Һ��0.05molŨ������Һ��Ϻ�ų�������Ϊ57.3kJ |
| D������1mol Ba��OH��2��ϡ��Һ�뺬2molHCl��ϡ��Һ��Ϻ�ų�����������114.6kJ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com