
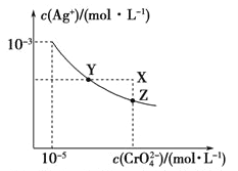
【题目】已知t℃时AgCl的溶度积Ksp=4×10-10,在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。请回答下列问题:
(1)Ag2CrO4沉淀溶解平衡的Ksp表达式为____________________________;
(2)①向Ag2CrO4沉淀中滴加氯化钠溶液,可见到红色沉淀慢慢转变为白色沉淀,写出沉淀转化的离子方程式______________________________________________________;
②该沉淀转化反应平衡常数的值为_____________________。
【答案】 Ksp=c2(Ag+)·c(CrO42-) Ag2CrO4(s)+2Cl-(aq) ![]() 2AgCl(s)+CrO42-(aq)
2AgCl(s)+CrO42-(aq) ![]()
【解析】(1)Ag2CrO4沉淀溶解平衡的Ksp表达式为Ksp=c2(Ag+)·c(CrO42-);(2)①向Ag2CrO4沉淀中滴加氯化钠溶液,可见到红色沉淀慢慢转变为白色沉淀,则为Ag2CrO4转化为AgCl,沉淀转化的离子方程式为:Ag2CrO4(s)+2Cl-(aq) ![]() 2AgCl(s)+CrO42-(aq);②t℃时,根据图中信息可知,若c(Ag+)=10-3mol/L,c(CrO42-)=10-5mol/L ,Ksp=c2(Ag+)·c(CrO42-)=(10-3mol/L)2×10-5mol/L=10-11 mol3/L3,AgCl的溶度积Ksp=4×10-10,
2AgCl(s)+CrO42-(aq);②t℃时,根据图中信息可知,若c(Ag+)=10-3mol/L,c(CrO42-)=10-5mol/L ,Ksp=c2(Ag+)·c(CrO42-)=(10-3mol/L)2×10-5mol/L=10-11 mol3/L3,AgCl的溶度积Ksp=4×10-10, ![]() =
= =
=![]() =4×10-7mol/L,该沉淀转化反应平衡常数的值为K=
=4×10-7mol/L,该沉淀转化反应平衡常数的值为K= =
= =
=![]() 。
。


 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:
【题目】氢气、碳氧化物是合成可再生能源甲醇的基础原料,具有重要的应用前景。
(1)已知H2(g)、CO(g)和CH4(g)的燃烧热分别为285.8 kJ·mol-1、283.0 kJ·mol-1和890.0 kJ·mol-1。一定条件下,CO与H2合成甲烷的热化学方程式为:CO(g)+3H2(g)==CH4(g)+H2O(1)△H
则△H=________;该反应能自发进行的原因是_____________________________________。
(2)工业上一般采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
反应II:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
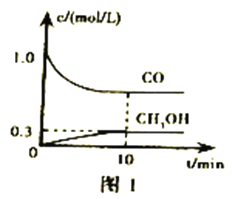
①一定温度下,在体积可变的恒压密闭容器中加入4molH2和一定量的CO发生反应I,开始时容器体积为2L,CO和CH3OH(g)的浓度随时间变化如图1。10min达到平衡,则反应I的化学平衡常数为______________(结果保留一位小数)。
②恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2,下列描述能说明反应II已经达到平衡状态的是________________(填序号)。
A.容器内CO2的体积分数不再变化 B.当CO2和H2转化率的比值不再变化
C.当水分子中断裂2NA个O-H键,同时氢分子中断裂3NA个H-H键
D.容器内混合气体的平均相对分子质量达到34.5,且保持不变
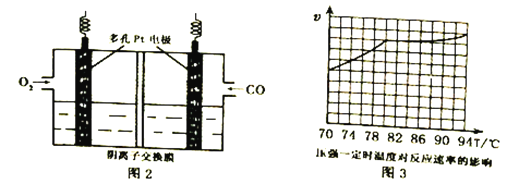
(3)用KOH作电解质的CO碱性燃料电池(如图2)作电源,用惰性电极电解含CN-废水,将CN-彻底氧化为无害气体,以净化废水。该电池的负极反应式为_____________;若开始时正、负两电极区溶液质量相等,当除去1molCN-时,理论上两电极区溶液的质量差为______g。
(4)工业上通过CO与甲醇制取甲酸甲酯,热化学方程式为:CO(g)+ CH3OH(g) ![]() HCOOCH3(g)△H =-29kJ·mol-1 。科研人员对该反应进行了研究,部分研究结果如图3。实际工业生产中采用的温度是80℃,其理由是__________________________。
HCOOCH3(g)△H =-29kJ·mol-1 。科研人员对该反应进行了研究,部分研究结果如图3。实际工业生产中采用的温度是80℃,其理由是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组同学用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件。
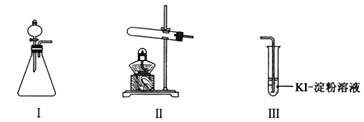
供选试剂:30% H2O2溶液、0.1mol/L H2SO4溶液、MnO2固体、KMnO4固体。
(1)小组同学设计甲、乙、丙三组实验,记录如下:
操作 | 现象 | |
甲 | 向I的锥形瓶中加入______,向I的______中加入30% H2O2溶液,连接I、Ⅲ,打开活塞 | I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝 |
乙 | 向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液不变蓝 |
丙 | 向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1mol/L H2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液变蓝 |
(2)丙实验中O2与KI溶液反应的离子方程式是__________________________。
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是___________。为进一步探究该条件对反应速率的影响,可采取的实验措施是________________________。
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝。学生将I中产生的气体直接通入下列________溶液(填序号),证明了白雾中含有H2O2。
A.酸性KMnO4 B.FeCl2 C.氢硫酸 D.品红
(5)资料显示:KI溶液在空气中久置过程中会被缓慢氧化:4KI +O2 +2H2O=2I2 + 4KOH。该小组同学取20 mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应(写离子方程式)_____________________造成的,请设计实验证明他们的猜想是否正确。_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积的硫酸钾、硫酸铜、硫酸铝溶液分别与足量氯化钡溶液反应。若生成硫酸钡沉淀的质量比为1:2:3,则三种硫酸盐的物质的量浓度之比为
A. 1:2:3 B. 1:6:9 C. 1:2:1 D. 3:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,浓度均为0.2 mol/L 的NaHCO3 和Na2CO3 溶液中,下列判断不正确的是
A. 均存在电离平衡和水解平衡
B. 存在的粒子种类相同
C. c(OH-)前者大于后者
D. 分别加入少量NaOH固体,恢复到原温度,pH均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液电导率越大导电能力越强。常温下用0.100 mol·L-1盐酸分别滴定10.00 mL浓度均为0.100 mol·L-1的NaOH溶液和氨水溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是

A. 曲线①代表滴定氢氧化钠溶液的曲线
B. 滴定氨水的过程应该选择酚酞作为指示剂
C. b点溶液中:c(H+)>c(OH-)+c(NH4+)+c(NH3·H2O)
D. a、b、c、d四点的溶液中,水的电离程度最大的是c点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低温迫使植物细胞产生大量对细胞有害的过氧化物,如脂质过氧化物(MDA)。超氧化物歧化酶(SOD)能够消除过氧化物,从而增强植物的抗冷性。研究人员进行了“水杨酸对水稻幼苗抗冷性的影响”实验,实验步骤及结果如表所示。
组别 | 处理 | 培养温度 /℃ |
|
1 | 蒸馏水浇灌 | 25 | 7.3 |
2 | ① | ② | 9.4 |
3 | 0.5 mmol/L水杨酸浇灌 | 5 | 10.3 |
4 | 1.0 mmol/L水杨酸浇灌 | 5 | 11.6 |
5 | 1.5 mmol/L水杨酸浇灌 | 5 | 13.6 |
6 | 2.0 mmol/L水杨酸浇灌 | 5 | 8.5 |
7 | 2.5 mmol/L水杨酸浇灌 | 5 | 7.9 |
8 | 3.0 mmol/L水杨酸浇灌 | 5 | 6.5 |
(1)表中①是 ,②是 ,其的作用为 ,实验设计时每组取50株水稻幼苗,而不是1株,目的是 。
(2)本实验自变量为 , ,需要控制的无关变量有 , (至少写两个)。
(3)组别1和2对照可得的结论是 。对比组别2~8可得的结论是 。
(4)在5 ℃的环境下,物质的量浓度为2.0 mmol/L的水杨酸对水稻幼苗抗冷性的影响是 (填“增强”或“减弱”)。
(5)请根据5 ℃条件下的实验结果完成水杨酸浓度—SOD活性关系的坐标曲线图。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com