
����Ŀ��
�뼰�仯�����Ӧ�������汻���ӡ�
��l������Ҫ�ĺ������������ʯ����2������Cr��������ʯ��Ϊ��ĸ�̡���̬Crԭ�Ӽ۵��ӵĹ����ʾʽΪ__________��
��2�����������������Ԫ���������ơ������й��������������ȷ����_____�����ţ���
A��������p������Ԫ�� B���縺�Զ���þ��
C����һ�����ܶ���þ�� D.�Ȼ����ˮ��ҺpH��С��7
��3���롢�����嶼���ɽ���ԭ�����ò�����ά�ռ�ѻ����ɣ����ܶѻ���������۵�(155lK)�������۵�(930K)�ߣ�ԭ����______________��
��4���Ȼ�������̬ʱ����BeC12���ӣ�a���Ͷ��۷��ӣ�BeCl2)2(b)����̬ʱ���������ͼ��ʾ����״�ṹ��c����

�� a����__________����������Ǽ����������ӡ�
�� b��Beԭ�ӵ��ӻ���ʽ��ͬ��������ԭ�Ӷ���ͬһƽ���ϡ�b �ĽṹʽΪ____ �������λ������
�� c��Beԭ�ӵ��ӻ���ʽΪ__________��
�� �Ȼ��뾧���д��ڵ���������__________�����ţ���
A�����»��� B. �Ҽ� C.���Լ� D���Ǽ��Լ� E�����Ӽ�
��5��BeO������������ͼ��ʾ��

�� BeO�����У�O2-����λ��Ϊ___________��
�� ��BeO������ܶ�Ϊdg/cm3��������a =______nm ���г�����ʽ���ɣ���
���𰸡� ![]() B��D Beԭ�Ӱ뾶��Alԭ�Ӱ뾶С����������ǿ �Ǽ���
B��D Beԭ�Ӱ뾶��Alԭ�Ӱ뾶С����������ǿ �Ǽ���  sp3 A��B��C 4
sp3 A��B��C 4 ![]()
����������l��Cr����������24�����ݺ�������Ų����ɿ�֪��̬Crԭ�Ӽ۵��ӵĹ����ʾʽΪ![]() ����2��A��Be����s������Ԫ�أ�A����B�������Զ�����þ����˵縺�Զ���þ��B��ȷ��C��Mg��3s�������ȫ����������һ�����ܱ�����C����D.�Ȼ�������ˮ��ˮ�⣬��Һ�����ԣ�ˮ��ҺpH��С��7��D��ȷ����3��Beԭ�Ӱ뾶��Alԭ�Ӱ뾶С����������ǿ���������۵�(155lK)�������۵�(930K)�ߡ���4����BeC12������ֱ���νṹ�����ڷǼ��Է��ӡ��� ��ԭ���ṩ�¶Ե��ӣ����b�ĽṹʽΪ
����2��A��Be����s������Ԫ�أ�A����B�������Զ�����þ����˵縺�Զ���þ��B��ȷ��C��Mg��3s�������ȫ����������һ�����ܱ�����C����D.�Ȼ�������ˮ��ˮ�⣬��Һ�����ԣ�ˮ��ҺpH��С��7��D��ȷ����3��Beԭ�Ӱ뾶��Alԭ�Ӱ뾶С����������ǿ���������۵�(155lK)�������۵�(930K)�ߡ���4����BeC12������ֱ���νṹ�����ڷǼ��Է��ӡ��� ��ԭ���ṩ�¶Ե��ӣ����b�ĽṹʽΪ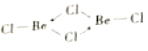 ����c��Beԭ�ӵļ۲���Ӷ�����4���ӻ���ʽΪsp3�����Ȼ��뾧���д��ڵ��������з��»������Ҽ������Լ�����ѡA��B��C����5���ٸ���BeO����Ľṹ���ж�O2-����λ��Ϊ4���ھ�������ԭ�Ӹ�����8��1/8+6��1/2=4��Beԭ�Ӹ�����4����BeO������ܶ�Ϊdg/cm3��������a=
����c��Beԭ�ӵļ۲���Ӷ�����4���ӻ���ʽΪsp3�����Ȼ��뾧���д��ڵ��������з��»������Ҽ������Լ�����ѡA��B��C����5���ٸ���BeO����Ľṹ���ж�O2-����λ��Ϊ4���ھ�������ԭ�Ӹ�����8��1/8+6��1/2=4��Beԭ�Ӹ�����4����BeO������ܶ�Ϊdg/cm3��������a= 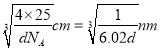 ��
��


 ��ְٷְټ���ϵ�д�
��ְٷְټ���ϵ�д� �����ƻ���ĩ��̶�100��ϵ�д�
�����ƻ���ĩ��̶�100��ϵ�д� �ܿ���ȫ��100��ϵ�д�
�ܿ���ȫ��100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������10mL0.1mol��L1��NH3��H2O��Һ,����˵����ȷ����( )
A. 25��ʱ,����Һ��pH=11,��Kb(NH3��H2O)=1��106
B. ����Һ�м�������CH3COONa����,��Һ��c(NH3��H2O)/c(NH4+)��ֵ��С
C. ����Һ�м���10mL0.1mol��L1����,������Һ������Ũ�ȴ�С˳��Ϊ��c(NH4+)>(Cl)>c(H+)>c(OH)
D. ����Һ�м���5mL0.1mol��L1����,������Һ�����ӵ�Ũ��һ�����ϣ�c(NH4+)+c(H+)=c(Cl)+c(OH)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����
��һ��ʵ��������һƿ����һ�������ʵ��ռ���Ʒ��ijѧ�����к͵ζ����ⶨ�ռ�Ĵ��ȣ����ռ����������������Ӧ�������ʵ��ش�

��1����ȷ��ȡ��5g�ռ���Ʒ���100 mL����Һ����Ҫ����Ҫ��������Ͳ���ձ�����������������ƽ�⣬�������õ��������У�____________��_____________��
��2��ȡ10.00 mL����Һ��ѡ����ͼ��_________����A��B������ȡ��
��3����0.5000mol/L������ζ������ռ���Һ���Է�̪Ϊָʾ�����ζ�ʱ������ת�ζ��ܲ������������ֲ�ͣ��ҡ����ƿ������ע��___________________��ֱ���ζ��յ㡣�ζ��ﵽ�յ�ı�־�ǣ�_______________________________��
��4�������������ݣ��ռ�Ĵ���Ϊ��_______________________
�ζ����� | ����Һ�����mL�� | �����������mL�� | |
�ζ�ǰ���� | �ζ������ | ||
��һ�� | 10.00 | 0.50 | 20.40 |
�ڶ��� | 10.00 | 4.00 | 24.10 |
��5���ж����в������������ƫ��ƫС����Ӱ�죩
�ٵζ�ǰ������ȷ���ζ��յ����ʱ����_________________
��װ����Һǰ����ƿ�ڲ�����������ˮ_______________
������������ԭ�ζ�ʵ��������к͵ζ����ƣ�����֪Ũ�ȵ���������Һ�ζ�δ֪Ũ�ȵĻ�ԭ����Һ��֮������Ѫ�Ƶĺ���ʱ����������ʵ�飺
�ٿɽ�2mLѪҺ������ˮϡ�ͺ������м�����������泥�NH4��2C2O4���壬��Ӧ���� CaC2O4��������������ϡ���ᴦ����H2C2O4��Һ��
�ڽ��ٵõ���H2C2O4��Һ����������KMnO4��Һ�ζ�����������ΪCO2����ԭ����ΪMn2+��
���յ�ʱ��ȥ20mL l.0��l0��4 mol/L��KMnO4��Һ��
��1��д����KMn04�ζ�H2C2O4�����ӷ���ʽ_____________________��
��2���ζ�ʱ����KMnO4��Һװ��________�����ʽ����ʽ�����ζ����С�
��3�������������ƫ�ߡ�����ƫ�͡�����Ӱ�족��
������ζ���������ˮϴ��δ������KMnO4��Һ��ϴ����������________��
�ڵζ�ǰ���������ȷ�����ζ�ǰ�����ݣ����ζ���������ʧ����������________��
��4�����㣺ѪҺ�к������ӵ�Ũ��Ϊ_____mol��L-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Q��W��X��Y��Z��ԭ��������������Ķ�����Ԫ�أ�Q��Y��������������������������ȣ�Q��X��W��Zͬ���壬Q��W���γ�ԭ�Ӹ���֮��Ϊ1��1��2��1�ij������������˵����ȷ����
A. ԭ�Ӱ뾶��Z>Y>X>W>Q
B. Q��X�γɵĻ�����ĵ���ʽΪ��![]()
C. ����⻯����ȶ��ԣ�Z>W
D. ��ҵ�ϳ��õ��ķ����Ʊ�X��Y�ĵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������������������أ������뻯ѧ�йص�˵���������
A. ˮ��������ľ�ķ���������ȼ��
B. ����Į����ֱ�������������������Ĺ���
C. �����dz��õĺ�ˮ�����ķ���֮һ
D. ���������ˮ���ԭ���������մɵ�ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2008��9��27��16�s43���й����߳����й����������Ƶĺ���ɴ������а�����ѧʵ�����ڵij��ջ����־���й��Ѿ���Ϊ�����ϼ̶�����֮��������ܹ����зɴ������Ĺ��ҡ��ڷɴ��Ļ���ƽ����г�װ��Һ̬�£���A��ʾ���������⣨H2O2�������ǻ��ʱ�ķ�Ӧ����ʽΪ��2H2O2+A=N2+4H2O�����£�A���Ļ�ѧʽΪ
A. N2H2 B. N2H4 C. NH2 D. N2H4O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ȼʳ������X�Ƿ����廯������Դ�ijЩֲ������ȡ����X�ϳ�H��·�����£�

��֪����A�ĺ˴Ź���������6���壻��HΪ�������ʣ��ṹ�г����������һ����Ԫ������G�IJ����Ǻ���һ������ʯ�ͻ�����չˮƽ�ı�־��
��ش��������⣺
��1��A�Ľṹ��ʽΪ______������A�зǺ������������õ��Լ�Ϊ_______��
��2���ڵķ�Ӧ����Ϊ____________����Ӧ�۵Ļ�ѧ����ʽΪ_____________��
��3��F�����������ŵ�����Ϊ____________����ͬ���칹���У���FeCl3��Һ������ɫ��Ӧ��������̼��������Һ��Ӧ���䱽����һ�ȴ���ֻ��һ�֣�����������ͬ���칹����ĿΪ________�֣�д������һ�ֽṹ��ʽ��____________��
��4�����һ����GΪ��ʼԭ�Ϻϳ��Ҷ����·��______________��������ѡ��ע����Ӧ������ʾ�����£� ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�������������������,����˵����ȷ����
A. ά����D�ɴٽ�����Ը�������
B. ����ֱ���õ�����Һ���麣ˮ���Ƿ�Ԫ��
C. �л���������Ҫ�ɷ��ǹ�����
D. ʯ�͵ķ��������Ҫ�漰��ѧ�仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ�ҽ�����Ԫ��Ǧ��봵�ԭ�Ӻ˶�ײ�������һ��������Ϊ118��������Ϊ293�ij���Ԫ�أ���Ԫ��ԭ�Ӻ��ڵ��������ͺ��������֮��Ϊ���� ����
A. 175 B. 47 C. 118 D. 57
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com