
【题目】填写下表中的空格:___
微粒 符号 | 质子数 | 中子数 | 质量数 | 核外 电子数 | 电子式 | 结构示意图 |
39K | ||||||
S2﹣ | 18 | |||||
14 | 27 | 10 |
【答案】
微粒 符号 | 质子数 | 中子数 | 质量数 | 核外 电子数 | 电子式 | 结构示意图 |
39K | 19 | 20 | 39 | 19 | K |
|
S2﹣ | 16 | 34 | 18 |
|
| |
Al3+ | 13 | Al3+ |
|
【解析】
元素的质子数=原子序数=元素原子核外电子数=核电荷数;
元素的质量数=质子数+中子数;
元素原子的电子式表示的是在元素符号周围用黑点"."和叉"×"来表示元素原子的最外层电子,而阳离子的电子式直接用阳离子表示即可(铵根离子除外),阴离子的电子式要表明得电子后最外层电子的情况;
结构示意图指的是小圈和圈内的数字表示原子核和核内质子数,弧线表示电子层,弧线上的数字表示该层的电子数,根据核外电子排布规律分析作答。
39K是19号元素,质子数=核电荷数=核外电子数=19,质量数=质子数+中子数=39,中子数=20,元素符号左上角为质量数,左下角为质子数,最外层一个电子,核外有四个电子层,电子式K,原子结构示意图: ,
,
S2﹣是阴离子,质子数=核电荷数=16,质量数=质子数+中子数=18+16=34,元素符号左上角为质量数,离子核外电子数=18,左下角为质子数,最外层8个电子,核外有三个电子层,硫离子为阴离子,需要标出最外层8个电子,硫离子的电子式为![]() ,硫离子核外电子数为18,其结构示意图为:
,硫离子核外电子数为18,其结构示意图为: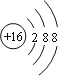 ,
,
质子数=质量数﹣中子数=27﹣14=13,为铝元素,核外电子数10,说明失去三个电子形成的铝离子,离子核外两个电子层,最外层8个电子,铝离子电子式:Al3+,铝离子的结构示意图为: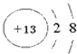 ,
,
故答案为:
微粒 符号 | 质子数 | 中子数 | 质量数 | 核外 电子数 | 电子式 | 结构示意图 |
39K | 19 | 20 | 39 | 19 | K |
|
S2﹣ | 16 | 34 | 18 |
|
| |
Al3+ | 13 | Al3+ |
|


科目:高中化学 来源: 题型:
【题目】为了测定某草酸(H2C2O4)溶液的浓度,进行如下实验:
取25.00mL某草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为0.10molL-1的KMnO4溶液滴定到终点,所发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O试回答:
(1)实验中,标准液KMnO4溶液应装在________式滴定管中,因为_____________;
(2)实验中眼睛注视_________________,直至滴定终点;判断到达终点的现象是___________________________________________ ;
(3)若实验所用KMnO4溶液体积为21.00mL,则草酸溶液的浓度为_______________;
(4)实验中,下列操作(其它操作均正确),会对所测草酸浓度有什么影响?(填偏大、偏小、无影响)
A.滴定前仰视刻度,滴定后俯视刻度________________________;
B.锥形瓶在盛放待测液前未干燥,有少量蒸馏水______________________________;
C.滴定过程中摇动锥形瓶,不慎将瓶内的溶液溅出一部分______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中发生反应:2A(g)+B(g)![]() 2C(g) ΔH ,图1表示该反应在不同温度下B的转化率随温度变化曲线,图2表示该反应的反应速率(v)随时间(t)变化图像。
2C(g) ΔH ,图1表示该反应在不同温度下B的转化率随温度变化曲线,图2表示该反应的反应速率(v)随时间(t)变化图像。

请回答下列问题:
(1)图中a、b、c三点的化学反应速率(v)由快到慢是__________。
(2)图中该反应的ΔH_______0。
(3)图中a、b、c三点,未达到平衡状态且v正>v逆的点是_______。

请回答下列问题:
(4)图中t2时刻改变的外界条件是___________。
(5)图中从t1 ~ t6 反应物转化率最低的是_______时刻。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾FeSO47H2O广泛用于医药和工业领域。以下是FeSO47H2O的实验室制备流程图。根据题意完成下列填空:

(1)碳酸钠溶液能除去酯类油污,是因为_________________________(用离子方程式表示),反应Ⅰ需要加热数分钟,其原因是______________________________。
(2)废铁屑中含氧化铁,反应II的离子方程式____________________,判断反应II完成的现象是: ______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科学技术的发展,阿佛加德罗常数的测定手段越来越多,测定的精度也越来越高。现有一种简单可行的测定方法,具体步骤为:
①将NaCl固体研细、干燥后,准确称取mgNaCl固体并转移到定容仪器A中。
②用滴定管向A仪器中加苯,不断振荡,继续加苯到A仪器的刻度,计算出NaCl固体的体积为Vcm3。
(1)步骤①中仪器A最好使用___(填序号)。
A.量筒 B.烧杯 C.容量瓶 D.试管
(2)步骤②中是用酸式滴定管还是用碱式滴定管___,理由是___。
(3)能否用水代替苯___(填“是”或“否”),理由是___。
(4)已知NaCl晶体中,靠得最近的Na+、Cl﹣间的距离为acm(如图),则用上述方法测得的阿佛加德常数NA的表达式为___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10﹣5 | Ka1=4.3×10﹣7 Ka2=5.6×10﹣11 | Ka=3.0×10﹣8 |
(1)物质的量浓度均为0.1molL﹣1的四种溶液:pH由小到大排列的顺序是___________(用编号填写)
a.CH3COONab.Na2CO3 c.NaClOd.NaHCO3
(2)常温下,0.1molL﹣1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是_________(填字母)
A.c(H+) B.![]() C.c(H+)c(OH﹣)
C.c(H+)c(OH﹣)
D.![]() E.
E.![]()
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:___________
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO﹣)﹣c(Na+)=________(填准确数值).
(5)25℃时,将a molL﹣1的醋酸与b molL﹣1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为_________________
(6)标准状况下,将1.12L CO2通入100mL 1molL﹣1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式: c(OH﹣)=2c(H2CO3)+______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是( )
A. HCl和NaOH反应的中和热ΔH=﹣57.3 kJ·mol-1![]() ,则H2SO4和Ca(OH)2反应的中和热是ΔH=2×(﹣57.3)kJ·mol-1
,则H2SO4和Ca(OH)2反应的中和热是ΔH=2×(﹣57.3)kJ·mol-1
B. 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
C. 需要加热才能发生的反应一定是吸热反应
D. CO(g)的燃烧热是283.0 kJ·mol-1![]() ,则2CO2(g)====2CO(g)+O2(g)反应的ΔH=+566.0 kJ·mol-1
,则2CO2(g)====2CO(g)+O2(g)反应的ΔH=+566.0 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高碘酸钾(KIO4)溶于热水,微溶于冷水和氢氧化钾溶液,可用作有机物的氧化剂。制备高碘酸钾的装置图如下(夹持和加热装置省略)。回答下列问题:

(1)装置I中仪器甲的名称是___________。
(2)装置I中浓盐酸与KMnO4混合后发生反应的离子方程式是___________。
(3)装置Ⅱ中的试剂X是___________。
(4)装置Ⅲ中搅拌的目的是___________。
(5)上述炭置按气流由左至右各接口顺序为___________(用字母表示)。
(6)装置连接好后,将装置Ⅲ水浴加热,通入氯气一段时间,冷却析岀高碘酸钾晶体,经过滤,洗涤,干燥等步骤得到产品。
①写出装置Ⅲ中发生反应的化学方程式:___________。
②洗涤时,与选用热水相比,选用冷水洗涤晶体的优点是___________。
③上述制备的产品中含少量的KIO3,其他杂质忽略,现称取ag该产品配制成溶液,然后加入稍过量的用醋酸酸化的KI溶液,充分反应后,加入几滴淀粉溶液,然后用1.0mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液的平均体积为bL。
已知:KIO3+5KI+6CH3COOH===3I2+6CH3COOK+3H2O
KIO4+7KI+8CH3 COOH===4I2+8CH3COOK+4H2O
I2+2Na2S2O3===2NaI+N2S4O6
则该产品中KIO4的百分含量是___________(Mr(KIO3)=214,Mr(KIO4)=230,列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是一种白色剧毒晶体,是汽车安全气囊的主要成分。NaN3易溶于水,微溶于乙醇,水溶液呈弱碱性,能与酸发生反应产生具有爆炸性的有毒气体叠氮化氢。实验室可利用亚硝酸叔丁酯(t-BuNO2,以t-Bu表示叔丁基)与N2H4、氢氧化钠溶液混合反应制备叠氮化钠。
(1)制备亚硝酸叔丁酯
取一定NaNO2溶液与50%硫酸混合,发生反应H2SO4+2NaNO2===2HNO2+Na2SO4。可利用亚硝酸与叔丁醇(t-BuOH)在40 ℃左右制备亚硝酸叔丁酯,试写出该反应的化学方程式:________________。
(2)制备叠氮化钠(NaN3)
按如图所示组装仪器(加热装置略)进行反应,反应方程式为:t-BuNO2+NaOH+N2H4===NaN3+2H2O+t-BuOH。

①装置a的名称是________________;
②该反应需控制温度在65 ℃,采用的实验措施是____________________;
③反应后溶液在0 ℃下冷却至有大量晶体析出后过滤,所得晶体使用无水乙醇洗涤。试解释低温下过滤和使用无水乙醇洗涤晶体的原因是______________________________________________。
(3)产率计算
①称取2.0 g叠氮化钠试样,配成100 mL溶液,并量取10.00 mL溶液于锥形瓶中。
②用滴定管加入0.10 mol·L-1六硝酸铈铵[(NH4)2Ce(NO3)6]溶液40.00 mL[发生的反应为2(NH4)2Ce(NO3)6+2NaN3===4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑](假设杂质均不参与反应)。
③充分反应后将溶液稀释并酸化,滴入2滴邻菲罗啉指示液,并用0.10 mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]为标准液,滴定过量的Ce4+,终点时消耗标准溶液20.00 mL(滴定原理:Ce4++Fe2+===Ce3++Fe3+)。计算可知叠氮化钠的质量分数为__________(保留2位有效数字)。若其他操作及读数均正确,滴定到终点后,下列操作会导致所测定样品中叠氮化钠质量分数偏大的是______(填字母代号)。
A.锥形瓶使用叠氮化钠溶液润洗
B.滴加六硝酸铈铵溶液时,滴加前仰视读数,滴加后俯视读数
C.滴加硫酸亚铁铵标准溶液时,开始时尖嘴处无气泡,结束时出现气泡
D.滴定过程中,将挂在锥形瓶壁上的硫酸亚铁铵标准液滴用蒸馏水冲进瓶内
(4)叠氮化钠有毒,可以使用次氯酸钠溶液对含有叠氮化钠的溶液进行销毁,反应后溶液碱性明显增强,且产生无色无味的无毒气体,试写出反应的离子方程式:____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com