


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 用如图所示装置进行中和热测定实验,请回答下列问题:
用如图所示装置进行中和热测定实验,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
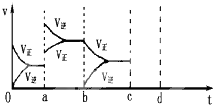 如图表示在密闭容器中反应:CO2(g)+C(s)?2CO(g)△H>0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是
如图表示在密闭容器中反应:CO2(g)+C(s)?2CO(g)△H>0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是查看答案和解析>>
科目:高中化学 来源: 题型:


 (R为烃基)
(R为烃基) 反应合成聚碳酯的化学方程式
反应合成聚碳酯的化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、构成原电池正极和负极的材料必须是两种金属 |
| B、由铜锌作为电极与硫酸铜溶液组成的原电池中,铜是负极 |
| C、电流通过硫酸溶液,SO42-向正极移动 |
| D、铜锌原电池工作时,若有13g锌被溶解,电路中就有0.4mol电子通过 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在硫酸亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O | ||||
B、MnO2与浓盐酸反应制取Cl2:MnO2+4HCl(浓)
| ||||
| C、过量的KHSO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | ||||
| D、向稀氢氧化钠溶液中通入少量CO2:OH-+CO2═HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
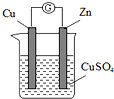 某实验兴趣小组按如图装置实验后,所记录内容合理的是( )
某实验兴趣小组按如图装置实验后,所记录内容合理的是( )| 实验 记录 | ①Cu为正极,Zn为负极; ②Zn质量减少,Cu质量不变; ③SO42- 向Cu极移动; ④电子流方向是:由Zn经导线流入Cu片; ⑤Zn电极发生还原反应; ⑥正极反应式:Cu2++2e-═Cu |
| A、①④⑥ | B、②③④ |
| C、①②⑤ | D、③⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com