
【题目】下列有关物质的性质和应用都正确的是( )
A.MgO、Al2O3熔点高,都可用于制作耐火材料
B.氨气显碱性,可用碱石灰或无水CaCl2干燥
C.氢氟酸具有强酸性,可用于雕刻玻璃
D.铜的活动性比铁弱,可在海轮外壳上装铜块以减缓海轮腐蚀
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】一氯甲烷(CH3Cl)是一种重要的化工原料,常温下它是无色有毒气体,微溶于水,易溶于乙醇、CCl4等。
(1)甲组同学在实验室用下图所示装置模拟催化法制备和收集一氯甲烷。
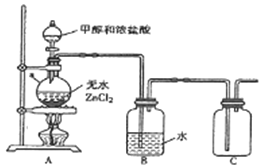
①仪器a的名称为___________。
②无水ZnCl2为催化剂,a瓶中发生反应的化学方程式为_____________。
③装置B的主要作用是_____________。
(2)乙组同学选用甲组A、B装置和下图所示的部分装置检验CH3Cl中的氯元素。
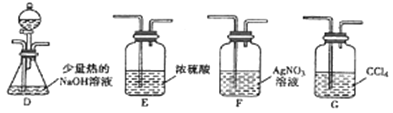
①乙组同学的实验装置中,依次连接的合理顺序为A→B→_____→_____→_____。
②通入一段时间的CH3Cl气体,打开装置D中分液漏斗的活塞先后加入两种试剂,观察实验现象。分液漏斗中先后加入的试剂是_______________。
③能证明CH3Cl中含有氯元素的实验现象是____________。
(3)查阅资料可知:AgNO3的乙醇溶液可以检验CH3Cl中的卤素原子。相关数据如下表:
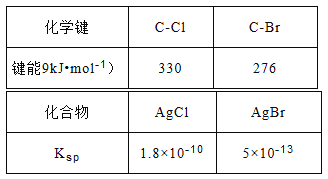
将CH3Cl和CH3Br的混合气体通入AgNO3的乙醇溶液中,先出现淡黄色沉淀。请依据表中数据解释原因__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池能长时间保持稳定的放电电压,有广泛的应用前景。总反应为:3Zn+2K2FeO4+8H2O ![]() 3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述错误的是
3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述错误的是
A. 充电时,Zn板应与外接电源的负极相连
B. 放电时,溶液中的OH-从正极向负极移动
C. 正极反应式为:FeO42-+3e-+4H2O= Fe(OH)3+5OH-
D. 充电时,当转移0.2mol电子时,阴极质量增加3.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢。
(1)A的结构简式为 ;
(2)A中的碳原子是否都处于同一平面? (填“是”或“不是”);
(3)已知A、B、C有如下转化关系:
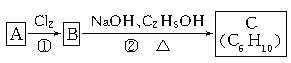
则反应②的化学方程式为 ;C的化学名称是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学-选修3:物质结构与性质】
南京理工大学化工学院胡炳成教授团队于2017年1月成功合成世界首个全氮阴离子盐,使氮原子簇化合物的研究又有了新的突破。请根据材料回答以下问题:
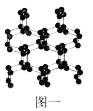
(1)N、O、F三种元素的第一电离能由大到小的顺序为____(填元素符号);与N2互为等电子体的全氧离子化学式为_______;具有空间网状结构的高聚氮结构如图一所示,则N70的沸点_____(填“>”、“<”或“=”)高聚氮的沸点,原因是_________________;N70和高聚氮属于_____(选填序号)。
A.同素异形体 B.同分异构体 C.同位素 D.同系物
(2)叠氮化物是研究较早的含全氮阴离子的化合物,如:氢叠氮酸(HN3)、叠氮化钠(NaN3) 等。叠氮化物能形成多种配合物,在[Co(N3)(NH3)5]SO4,其中钴显____价,它的配体是____,SO42-的立体构型为___________。
(3)HN3是一种全氮阴离子酸,可由肼(N2H4)被HNO2氧化制得。下列说法正确的是____。
A.酸性:HNO2>HNO2
B. N2H4分子中N原子均采取sp3杂化
C. NaN3的晶格能小于KN3的晶格能
D.上述生成氢叠氮酸的化学方程式为N2H4+HNO2=2H2O+HN3
(4)N8是一种由全氮阳离子和全氮阴离子构成的特殊物质,已知阳离子由5个氮原子排列成V 形,每个氮原子均达到八电子稳定结构,则阳离子的电子式为_______。
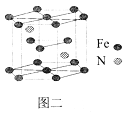
(5)一种氮铁化合物的结构如图二所示,若图中六棱柱的体积为Vcm3, 用NA表示阿伏加德罗常数的值,则该晶体的密度为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于0.5 mol NH3的下列说法中,不正确的是( )
A. 含有3.01×1023个氨气分子 B. 摩尔质量是8.5 g
C. 标况下的体积约为11.2L D. 含有2NA个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学镀镍是指不使用外加电流,利用氧化还原作用在金属制件的表面上沉积一层镍的方法。次磷酸钠(NaH2PO2)是化学镀镍的重要原料,工业上制备NaH2PO2·H2O的流程如下:

回答下列问题:
⑴次磷酸钠(NaH2PO2)是次磷酸(H3PO2)与足量NaOH溶液反应的产物,NaH2PO2属于_______(填“正盐”“酸式盐”“碱式盐”), NaH2PO2中磷元素的化合价为___________。
(2)在反应器中加入乳化剂并高速搅拌的目的是________________
(3)在反应器中发生多个反应,其中白磷(P4)与Ca(OH)2反应生成次磷酸钠及磷化氢的化学方程式为_________________________
(4)流程中通入CO2的目的是______________,滤渣X的化学式为_____________
(5)流程中母液中的溶质除NaH2PO2外,还有的一种主要成分为_____________
(6)含PH3的废气可用NaClO和NaOH的混合溶液处理将其转化为磷酸盐,该反应的离子方程式为____________
(7)某次生产投入的原料白磷为1240 kg,在高速乳化反应器中有80%的白磷转化为次磷酸钠及磷化氢,忽略其它步骤的损失,理论上最终得到产品NaH2PO2·H2O的质量应为__________kg(NaH2PO2·H2O的相对分子质量为106)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素A、B、C、D的原子序数依次增加。甲、丙、戊是由这些元素组成的二元化合物,丙分子中原子个数比为1:1,乙是元素D的单质,通常为深红棕色液体,丁为淡黄色固体,0.01 mol/L戊溶液的pH为2,己为难溶于水、密度比水大的油状物。上述物质的转化关系如图所示。下列说法中不正确的是
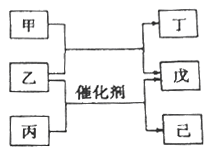
A. 四种元素既不同周期也不同主族
B. 元素的非金属性A<B<C
C. 丙常温常压下为气态
D. C的最高价氧化物对应的水化物为强酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com