
【题目】“中和滴定”原理在实际生产生活中应用广泛。用I2O5可定量测定CO的含量,该反应原理为5CO+I2O5![]() 5CO2+I2。其实验步骤如下:
5CO2+I2。其实验步骤如下:
①取250 mL(标准状况)含有CO的某气体样品通过盛有足量I2O5的干燥管中在170 ℃下充分反应;
②用水一乙醇液充分溶解产物I2,配制100 mL溶液;
③量取步骤②中溶液25.00 mL于锥形瓶中,然后用0.01 mol·L-1的Na2S2O3标准溶液滴定。消耗标准Na2S2O3溶液的体积如表所示。
第一次 | 第二次 | 第三次 | |
滴定前读数/mL | 2.10 | 2.50 | 1.40 |
滴定后读数/mL | 22.00 | 22.50 | 21.50 |
(1)步骤②中配制100 mL待测溶液需要用到的玻璃仪器的名称是烧杯、量筒、玻璃棒、胶头滴管和____________________。
(2)Na2S2O3标准液应装在__________(填字母)中。

(3)指示剂应选用__________,判断达到滴定终点的现象是____________________________________。
(4)气体样品中CO的体积分数为__________(已知:气体样品中其他成分不与I2O5反应:2Na2S2O3+I2=2NaI+Na2S4O6)
(5)下列操作会造成所测CO的体积分数偏大的是__________(填字母)。
a.滴定终点俯视读数
b.锥形瓶用待测溶液润洗
c.滴定前有气泡,滴定后没有气泡
d.配制100 mL待测溶液时,有少量溅出
【答案】 100mL容量瓶 B 淀粉溶液 滴加最后一滴标准液,溶液由蓝色变为无色且半分钟内不恢复原色 17.92% bc
【解析】(1)步骤②中配制100 mL待测溶液需要用到的玻璃仪器的名称是烧杯、量筒、玻璃棒、胶头滴管和100mL容量瓶。(2)Na2S2O3溶液显碱性,则Na2S2O3标准液应装在碱式滴定管中,即答案选B。(3)碘遇淀粉显蓝色,则指示剂应选用淀粉溶液,反应中单质碘被消耗,则判断达到滴定终点的现象是滴加最后一滴标准液,溶液由蓝色变为无色且半分钟内不恢复原色。(4)根据表中数据可知三次滴定消耗标准液体积分别是19.90mL、20.00mL、20.10mL,所以消耗标准液体积的平均值是20.00mL。根据方程式5CO+I2O5![]() 5CO2+I2、2Na2S2O3+I2=2NaI+Na2S4O6可知5CO~I2~2Na2S2O3,则气体样品中CO的体积分数为
5CO2+I2、2Na2S2O3+I2=2NaI+Na2S4O6可知5CO~I2~2Na2S2O3,则气体样品中CO的体积分数为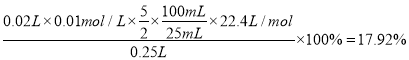 ;(5)a.滴定终点俯视读数,读数偏小,结果偏低,a错误;b.锥形瓶用待测溶液润洗,消耗标准液体积增加,结果偏高,b正确;c.滴定前有气泡,滴定后没有气泡,消耗标准液体积增加,结果偏高,c正确;d.配制100 mL待测溶液时,有少量溅出,浓度偏低,消耗标准液体积减少,结果偏低,d错误,答案选bc。
;(5)a.滴定终点俯视读数,读数偏小,结果偏低,a错误;b.锥形瓶用待测溶液润洗,消耗标准液体积增加,结果偏高,b正确;c.滴定前有气泡,滴定后没有气泡,消耗标准液体积增加,结果偏高,c正确;d.配制100 mL待测溶液时,有少量溅出,浓度偏低,消耗标准液体积减少,结果偏低,d错误,答案选bc。


科目:高中化学 来源: 题型:
【题目】利用图1 和图2中的信息,按图3装置(连接的A、B瓶中已充有NO2气体)进行实验。下列说法正确的是

A. H2O2中只含有极性共价键,不含离子键
B. 2NO2![]() N2O4的平衡常数K随温度升高而减小
N2O4的平衡常数K随温度升高而减小
C. 向H2O2中加入Fe2(SO4)3后,B中颜色变浅
D. H2O2分解反应中Fe2(SO4)3作催化剂,可以使反应的△H减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 作为一种重要的化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究着被列入国家863计划。催化剂常具有较强的选择性,即专一性。已知:
作为一种重要的化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究着被列入国家863计划。催化剂常具有较强的选择性,即专一性。已知:
反应Ⅰ:![]()
![]()
![]() △H=
△H=![]()
反应Ⅱ:![]()
![]()
![]()
![]()
(1)在恒温恒容装置中充入一定量的![]() 和
和![]() ,在某催化剂的作用下进行反应I,则下列有关叙述中正确的是___________________。
,在某催化剂的作用下进行反应I,则下列有关叙述中正确的是___________________。
A. 使用催化剂时,可降低该反应的活化能,加快其反应速率
B. 若测得容器内![]() 时,说明反应已达平衡
时,说明反应已达平衡
C. 当容器内![]() 时,说明反应已达平衡
时,说明反应已达平衡
D. 当测得容器内氧气浓度不再变化时,说明反应已达达平衡
(2)氨催化氧化时会发生上述两个竞争反应Ⅰ、Ⅱ。为分析某催化剂对该反应的选择性,1L密闭容器中充入1 mol ![]() 和2 mol
和2 mol ![]() ,测得有关物质的量关系如图
,测得有关物质的量关系如图
①该催化剂在高温时选择反应_______________(填“Ⅰ”或“Ⅱ”)。
②520℃时, ![]()
![]()
![]() 的平衡常数K表达式________。
的平衡常数K表达式________。
③有利于提高![]() 转化为
转化为![]() 的速率的措施有_________________。
的速率的措施有_________________。
A. 使用催化剂![]()
B. 将反应生成的![]() 及时移出
及时移出
C. 充入稀有气体
D. 投料比不变,增加反应物的浓度
E. 降低反应温度
(3)最近华南理工大提出利用电解法制![]() 并用产生的
并用产生的![]() 处理废氨水,装置如图
处理废氨水,装置如图
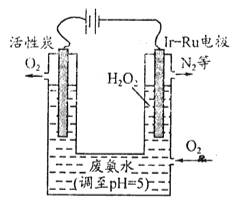
①为了不影响![]() 的产量,需要向废氨水加入适量硝酸调节溶液的pH约为5,则所得废氨水溶液中c(NH4+)_________c(NO3-)(填>、=、<)。
的产量,需要向废氨水加入适量硝酸调节溶液的pH约为5,则所得废氨水溶液中c(NH4+)_________c(NO3-)(填>、=、<)。
②Ir-Ru惰性电极有吸附![]() 作用,该电极上产生
作用,该电极上产生![]() 的反应为_________,生成的
的反应为_________,生成的![]() 与废液反应的离子方程式为_________________。
与废液反应的离子方程式为_________________。
③理论上电路中每转移3 mol电子,最多可以处理![]() 的物质的量为__________。
的物质的量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对金属制品进行抗腐蚀处理,可减缓金属的腐蚀,延长其使用寿命。
(1)以下为铝材表面处理的一种方法:

①碱洗的目的是除去铝表面的自然氧化膜(Al2O3),有关反应的离子方程式为_________________。碱洗时常有气泡冒出,该气体是_________ (填化学式)。
②电解时,处理好的铝材应与电源的________极相连,铝材表面形成氧化膜的电极反应式为_______。
(2)钢铁容易生锈的主要原因是钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀。在酸性环境下,其正极反应式为_________;在酸性很弱或中性条件下,其发生_______(填“析氢腐蚀”或“吸氧腐蚀”)。
(3)下列装置中铁片腐蚀由快到慢的顺序是____________(用序号表示)。

(4)利用如图装置,可以模拟铁的电化学防护。

若X为碳棒,开关K置于N处,该电化学防护法称为______;若X为锌棒,开关K置于M处,_____(填“能”或“不能”)达到防止铁腐蚀的目的。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A是农药生产中的一种中间体,其结构简式如图所示。则下列叙述正确的是

A. 有机物A的分子式为C10H11O4Cl
B. 有机物A能与溴水发生加成反应
C. 有机物A和浓硫酸混合加热,可以发生消去反应
D. 1molA和足量的NaOH溶液反应,最多可以消耗3molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼氢化钠(NaBH4,硼为+3价)为白色粉末,在干燥空气中稳定,在潮湿空气中分解,是常用的还原剂。偏硼酸钠(NaBO2)易溶于水,不溶于乙醇,易水解。目前有多种工艺制备NaBH4 。
(1)用硼精矿(含有一定量B2O3,及Al2O3、SiO2、Fe2O3等杂质)制取NaBH4的流程如下:

①“溶解”时,B2O3与NaOH反应生成了NaBO2,反应离子方程式为_____________。
②“除硅铝”步骤加入CaO,而不加入CaCl2的原因有:能将硅、铝以沉淀除去;尽量不带入杂质离子;__________。
③“操作2”是将滤液蒸发、结晶、洗涤,其中洗涤选用的试剂最好是___________。
④“反应1”是MgH2与NaBO2混合得到NaBH4和MgO,其化学方程式为_________。
(2)我国孙彦平采用耐腐蚀电极材料,以阳离子交换膜为隔离膜,电解偏硼酸钠的碱溶液,也可以高效制备NaBH4。该工艺阳极产物为______,阴极电极方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,其中X原子最外层电子数是内层电子数的两倍,元素Y的核电荷数等于W原子的最外层电子数,Z在空气中燃烧发出耀眼的白光。下列说法正确的是
A. X和Y的氧化物都是可导致酸雨的污染物
B. Z和W形成的化合物中既有离子键又有共价键
C. 最高价氧化物对应水化物的酸性由强到弱的顺序:W、Y、X
D. 原子半径由大到小的顺序:r(X)>r(Y)>r(Z)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1L的混合溶液中含有0.25 mol SO42-, 0.75 mol Cl-, 0.25 mol Na+, 其余全是H+,则H+的物质的量浓度为( )
A.2.5mol/LB.5mol/LC.0.1mol/LD.1mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com