
某同学进行实验研究时,欲配1.0mol•L-1Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2·8H2O试剂(化学式量:315)。在室温下配制溶液时发现所取试剂在足量的水中仅部分溶解,烧杯中存在大量未溶物。为探究原因,该同学查得Ba(OH)2·8H2O在283K、293K和303K时的溶解度(g/100g H2O)分别为2.5、3.9和5.6。
(1)烧杯中未溶物可能仅为BaCO3,理由是___________________________________。
(2)假设试剂由大量Ba(OH)2·8H2O和少量BaCO3组成,设计实验方案,进行成分检验。在答题纸上进一步完成实验步骤、预期现象和结论。(不考虑结晶水的检验;室温时BaCO3饱和溶液的pH=9.6)
限选试剂及仪器:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管
|
实验步骤 |
预期现象和结论 |
|
|
|
|
步骤2:取适量滤液于试管中,滴加稀硫酸。 |
|
|
步骤3:取适量步骤1中的沉淀于试管中,_____。 |
|
|
步骤4: |
|
将试剂初步提纯后,准确测定其中Ba(OH)2·8H2O的含量。实验如下:
(3)配制250ml 约0.1mol•L-1Ba(OH)2溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水,__________,将溶液转入_____________,洗涤,定容,摇匀。
(4)滴定:准确量取25.00ml所配制Ba(OH)2溶液于锥形瓶中,滴加指示剂,将__________(填“0.020”、“0.05”、“0.1980”或“1.5”)mol•L-1盐酸装入50ml酸式滴定管,滴定至终点,记录数据。重复滴定2次。平均消耗盐酸Vml。 计算Ba(OH)2·8H2O的质量分数=__________________(只列出算式,不做运算)
(5)室温下,________(填“能”或“不能”) 配制1.0 mol•L-1Ba(OH)2溶液。
(本题共12分) (1)由于Ba(OH)2·8H2O与空气中的CO2反应,所取试剂许多已变质为BaCO3,未变质的Ba(OH)2·8H2O在配制溶液时能全部溶解。(2分)
(2)(5分)
|
实验步骤 |
预期现象和结论 |
|
步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀。 |
|
|
步骤2:取适量滤液于试管中,滴加稀硫酸。 |
出现白色沉淀,说明该试剂中有Ba2+存在 |
|
步骤3:取适量步骤1中的沉淀于是试管中,滴加稀盐酸,连接带塞导气管将产生的气体导入澄清石灰水中。 |
澄清石灰水变混浊。说明该试剂中含有BaCO3 |
|
步骤4:取步骤1中的滤液于烧杯中,用pH计测定其pH。 |
pH明显大于9.6,说明该试剂中含有Ba(OH)2。 |
(3)搅拌溶解 250ml容量瓶中 (2分)
(4)(2分)0.1980;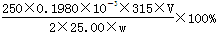
(5)不能。 (1分)
【解析】
试题分析:(1)Ba(OH)2属于强碱,易吸收空气中的水蒸气和CO2形成难溶的BaCO3沉淀,因此长时间暴露在空气中时Ba(OH)2就有可能转化为BaCO3。
(2)Ba(OH)2易溶于水,所以滤液中含有Ba2+,因此滴加稀硫酸使会产生白色沉淀BaSO4;要想验证沉淀为BaCO3,可以利用其能与酸反应产生能使澄清石灰水变浑浊的CO2气体;为进一步证明试剂是是否还有Ba(OH)2·8H2O,可以取步骤1中的滤液,用pH计测其pH值,若pH>9.6,即证明滤液不是纯BaCO3溶液,即证明是由大量Ba(OH)2·8H2O和少量BaCO3组成,假设成立。
(3)由于试样中含有难溶性的BaCO3,因此加水溶解后要过滤,且冷却后再转移到250ml容量瓶中。
(4)Ba(OH)2溶液的浓度约为0.1mol•L-1,体积是25ml,由于酸式滴定管的容量是50ml,因此盐酸的浓度至少应该是0.1 mol•L-1的.若盐酸的浓度过大,反应过快,不利于控制滴定终点,所以选择0.1980
mol•L-1的盐酸最恰当。消耗盐酸的物质的量是0.1980×V×10-3mol,所以25.00ml溶液中含有Ba(OH)2的物质的量是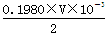 mol,所以w克试样中Ba(OH)2的质量是
mol,所以w克试样中Ba(OH)2的质量是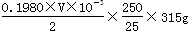 ,故Ba(OH)2·8H2O的质量分数=
,故Ba(OH)2·8H2O的质量分数=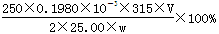 。
。
(5)若配制1L1.0 mol•L-1Ba(OH)2溶液,则溶液中溶解的Ba(OH)2·8H2O的质量是315g,所以此时的溶解度约是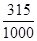 ×100=31.5 g/100g H2O,而在常温下Ba(OH)2·8H2O是3.9 g/100g H2O,显然不可能配制出1.0 mol•L-1Ba(OH)2溶液。
×100=31.5 g/100g H2O,而在常温下Ba(OH)2·8H2O是3.9 g/100g H2O,显然不可能配制出1.0 mol•L-1Ba(OH)2溶液。
考点:考查常见的实验步骤的设计、仪器和试剂的选择、一定物质的量浓度的配制以及有关计算等


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:上海市长宁区2013年高考一模化学试题 题型:058
某同学进行实验研究时,欲配制1.0 mol·L-1 Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2·8H2O试剂(化学式量∶315).在室温下配制溶液时发现所取试剂在足量的水中仅部分溶解,烧杯中存在大量未溶物.为探究原因,该同学查得Ba(OH)2·8H2O在283 K、293 K和303 K时的溶解度(g/100 g H2O)分别为2.5、3.9和5.6.
1.烧杯中未溶物可能仅为BaCO3,理由是________.
2.假设试剂由大量Ba(OH)2·8H2O和少量BaCO3组成,设计实验方案,进行成分检验.在答题纸上进一步完成实验步骤、预期现象和结论.(不考虑结晶水的检验;室温时BaCO3饱和溶液的pH=9.6)
限选试剂及仪器∶稀盐酸、稀硫酸、NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管

将试剂初步提纯后,准确测定其中Ba(OH)2·8H2O的含量.实验如下∶
3.配制250 ml约0.1 mol·L-1 Ba(OH)2溶液∶准确称取w克试样,置于烧杯中,加适量蒸馏水,________,将溶液转入________,洗涤,定容,摇匀.
4.滴定∶准确量取25.00 ml所配制Ba(OH)2溶液于锥形瓶中,滴加指示剂,将________(填“0.020”、“0.05”、“0.1980”或“1.5”)mol·L-1盐酸装入50 ml酸式滴定管,滴定至终点,记录数据.重复滴定2次.平均消耗盐酸Vml.计算Ba(OH)2·8H2O的质量分数=________(只列出算式,不做运算)
5.室温下,________(填“能”或“不能”)配制1.0 mol·L-1 Ba(OH)2溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
某同学进行实验研究时,欲配制1.0mol•L-1Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2·8H2O试剂(化学式量:315)。在室温下配制溶液时发现所取试剂在水中仅部分溶解,烧杯中存在大量未溶物。为探究原因,该同学查得Ba(OH)2·8H2O在283K、293K和303K时的溶解度(g/100g H2O)分别为2.5、3.9和5.6。
(1)烧杯中未溶物仅为BaCO3,理由是
(2)假设试剂由大量Ba(OH)2·8H2O和少量BaCO3组成,设计实验方案,进行成分检验。在答题卡上写出实验步骤、预期现象和结论。(不考虑结晶水的检验;室温时BaCO3饱和溶液的pH=9.6)
限选试剂及仪器:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀。 |
|
| 步骤2:取适量滤液于试管中,低价稀硫酸。 | |
| 步骤3:取适量步骤1中的沉淀于是试管中, 。 | |
| 步骤4: |
(3)将试剂初步提纯后,准确测定其中Ba(OH)2·8H2O的含量。实验如下:
①配制250ml 约0.1mol•L-1Ba(OH)2·8H2O溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水, ,将溶液转入 ,洗涤,定容,摇匀。
②滴定:准确量取25.00ml所配制Ba(OH)2溶液于锥形瓶中,滴加指示剂,将 (填“0.020”、“0.05”、“0.1980”或“1.5”)mol•L-![]() 1盐酸装入50ml酸式滴定管,滴定至终点,记录数据。重复滴定2次。平均消耗盐酸Vml。
1盐酸装入50ml酸式滴定管,滴定至终点,记录数据。重复滴定2次。平均消耗盐酸Vml。
③ 计算Ba(OH)2·8H2O的质量分数= (只列出算式,不做运算)
(4)室温下, (填“能”或“不能”) 配制1.0 mol•L-1Ba(OH)2溶液
查看答案和解析>>
科目:高中化学 来源:2012届浙江省严州中学高三10月阶段性测试化学试卷 题型:实验题
(12分)某同学进行实验研究时,欲配制1.0 mol·L-1 Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2·8H2O试剂(化学式量:315)。在室温下配制溶液时发现所取试剂在水中仅部分溶解,烧杯中存在大量未溶物。为探究其原因,该同学查得Ba(OH)2·8H2O在283 K、293 K和303 K时的溶解度(g/100 g H2O)分别为2.5、3.9和5.6。
(1)假设试剂由大量Ba(OH)2·8H2O和少量BaCO3组成。设计实验方案,进行成分检验。写出实验步骤、预期现象和结论。(不考虑结晶水的检验;室温时BaCO3饱和溶液的pH=9.6)
限选试剂及仪器:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀。 | |
| 步骤2:取适量滤液于试管中,滴加稀硫酸。 | |
| 步骤3:取适量步骤1中的沉淀于试管中,________。 | |
| 步骤4: | |
 _,将溶液转入________中,洗涤,定容,摇匀。
_,将溶液转入________中,洗涤,定容,摇匀。 填“能”或“不能”)配制1.0 mol·L-1 Ba(OH)2溶液。
填“能”或“不能”)配制1.0 mol·L-1 Ba(OH)2溶液。查看答案和解析>>
科目:高中化学 来源:2011年普通高等学校招生全国统一考试化学卷(广东) 题型:实验题
某同学进行实验研究时,欲配制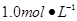 Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2·8H2O试剂(化学式量:315)。在室温下配制溶液时发现所取试剂在水中仅部分溶解,烧杯中存在大量未溶物。为探究原因,该同学查得Ba(OH)2·8H2O在283K、293K和303K时的溶解度(g/100g H2O)分别为2.5、3.9和5.6。
Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2·8H2O试剂(化学式量:315)。在室温下配制溶液时发现所取试剂在水中仅部分溶解,烧杯中存在大量未溶物。为探究原因,该同学查得Ba(OH)2·8H2O在283K、293K和303K时的溶解度(g/100g H2O)分别为2.5、3.9和5.6。
(1)烧杯中未溶物仅为BaCO3,理由是
(2)假设试剂由大量Ba(OH)2·8H2O和少量BaCO3组成,设计实验方案,进行成分检验。在答题卡上写出实验步骤、预期现象和结论。(不考虑结晶水的检验;室温时BaCO3饱和溶液的pH=9.6)
限选试剂及仪器:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管

(3)将试剂初步提纯后,准确测定其中Ba(OH)2·8H2O的含量。实验如下:
①配制250ml 约 Ba(OH)2·8H2O溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水, ,将溶液转入 ,洗涤,定容,摇匀。
Ba(OH)2·8H2O溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水, ,将溶液转入 ,洗涤,定容,摇匀。
②滴定:准确量取25.00ml所配制Ba(OH)2溶液于锥形瓶中,滴加指示剂,将
(填“0.020”、“0.05”、“0.1980”或“1.5”) 盐酸装入50ml酸式滴定管,滴定至终点,记录数据。重复滴定2次。平均消耗盐酸Vml。
盐酸装入50ml酸式滴定管,滴定至终点,记录数据。重复滴定2次。平均消耗盐酸Vml。
③ 计算Ba(OH)2·8H2O的质量分数= (只列出算式,不做运算)
(4)室温下,
(填“能”或“不能”) 配制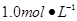 Ba(OH)2溶液。
Ba(OH)2溶液。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com