
【题目】下图为元素周期表的另一种画法——塔式周期表,上面标有部分族及部分元素。请根据周期表中所列的元素回答问题:
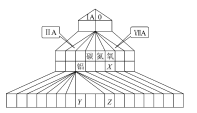
(1)碳、氮、氧三种元素的电负性由小到大的顺序为_____________________。
(2)Y3+的结构示意图为_____________,Z的价电子排布式为_______________。
(3)原子簇是由几个到几百个原子组成的相对独立的物质结构单元,如铝原子簇Al13、Al14。已知原子簇价电子总数为2,8,20,34,40,58……时,原子簇可稳定存在。
①Al13的化学性质与第__________族元素性质相似
②Al14达到稳定时,呈现的化合价为+2,其原因是___________________。
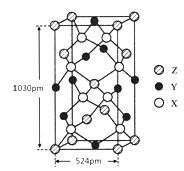
(4)某种化合物由X、Y、Z三种元素组成,其晶胞结构如图所示,则其化学式为____________,该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度:ρ=_______gcm-3(只要求列出计算式)。
【答案】C<N<O 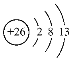 3d104s1 VIIA Al14价电子为42,原子簇要达到稳定结构即价电子40,需要失去2个电子 CuFeS2
3d104s1 VIIA Al14价电子为42,原子簇要达到稳定结构即价电子40,需要失去2个电子 CuFeS2 ![]()
【解析】
(1)同一周期元素的电负性随原子序数的增大而增大;
(2)根据元素在周期表的位置可知:X是S元素,Y是Fe元素,Z是Cu元素,Fe是26号元素,Fe原子失去3个电子变为Fe3+,据此书写Fe3+结构示意图;根据构造原理书写Cu的核外电子排布式及其价层电子排布式;
(3)原子簇是由几个到几百个原子组成的相对独立的物质结构单元,能稳定存在,原子簇价电子总数为2,8,20,34,40,58……时,原子簇可稳定存在判断其可能的化合价,确定相似元素族;
(4)用均摊方法计算晶胞中含有的Cu、Fe、S原子个数,求其最简式,得物质化学式,然后利用ρ=![]() 计算密度。
计算密度。
(1)同一周期元素的电负性随原子序数的增大而增大,所以C、N、O三种元素的电负性由小到大的顺序为C<N<O;
(2)根据上述分析可知Y是Fe,Z是 Cu元素。 Fe是26号元素,Fe原子失去3个电子变为Fe3+,则Fe3+结构示意图为: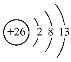 ;Cu是29号元素,Cu原子核外电子排布式是1s22s22p63s23p63d104s1,则Cu原子的价电子排布式为3d104s1;
;Cu是29号元素,Cu原子核外电子排布式是1s22s22p63s23p63d104s1,则Cu原子的价电子排布式为3d104s1;
(3)①Al13价电子数为13×3=39,由于原子簇价电子总数为2,8,20,34,40,58……时,原子簇可稳定存在,所以Al13得到1个电子就形成稳定结构,因此与元素周期表中VIIA的元素性质相似;
②Al14价电子数为14×3=42,由于原子簇价电子总数40时,原子簇可稳定存在,因此Al14失去2个电子后形成的+2价的离子为稳定结构;
(4)S原子位于晶胞内,1个晶胞中含有的S原子数目为:8个,Fe原子6个位于面上、4个位于棱上,则Fe原子数目=6×![]() +4×
+4×![]() =4,Cu原子有4个位于面上、1个位于晶胞内部、8个位于顶点上,则晶胞中含有的Cu原子数目=4×
=4,Cu原子有4个位于面上、1个位于晶胞内部、8个位于顶点上,则晶胞中含有的Cu原子数目=4×![]() +8×
+8×![]() +1=4,所以晶体中Cu、Fe、S原子数目之比=4:4:8=1:1:2,故该晶体化学式为:CuFeS2;晶胞质量m=
+1=4,所以晶体中Cu、Fe、S原子数目之比=4:4:8=1:1:2,故该晶体化学式为:CuFeS2;晶胞质量m=![]() ,晶胞体积V=(524×10-10 cm)2×103×10-10 cm,则该晶体的密度ρ=
,晶胞体积V=(524×10-10 cm)2×103×10-10 cm,则该晶体的密度ρ=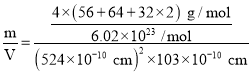 =
=![]() g/cm3。
g/cm3。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(题文)一定温度下,在容积固定的密闭容器中进行的可逆反应:2NO2![]() 2NO+O2,达到平衡的标志是
2NO+O2,达到平衡的标志是
①相同时间内,氧气的生成速率为n mol·L-1·s-1,NO2的生成速率为2n mol·L-1·s-1
②单位时间内生成n mol O2的同时生成2n mol的NO
③混合气体的颜色不再变化 ④混合气体的密度保持不变
⑤混合气体的平均相对分子质量不再改变 ⑥压强不随时间变化而变化
A. ①③⑤⑥ B. ②③⑤
C. ①③④ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示的原电池,下列说法正确的是( )。

A.锌是电池负极,发生还原反应
B.电子从铜电极通过电流计流向锌电极
C.盐桥中的阳离子向硫酸铜溶液中迁移
D.实验过程中取出盐桥,原电池仍继续工作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I-具有还原性,含碘食盐中的碘元素主要以KIO3的形式存在,I-、I2、IO3-在一定条件下可发生如图转化关系,下列说法不正确的是
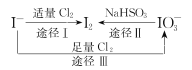
A.用淀粉-KI试纸和食醋可检验食盐是否加碘
B.由图可知氧化性的强弱顺序为Cl2>IO3->I2
C.生产等量的碘,途径I和途径II转移电子数目之比为5 :2
D.途径III反应的离子方程式:3Cl2+I-+3H2O=6Cl-+IO3-+6H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了三位为锂离子电池发展做出巨大贡献的科学家,锂离子电池广泛应用于手机、笔记本电脑等。
(1)锂元素在元素周期表中的位置:_________________。
(2)氧化锂(Li2O)是制备锂离子电池的重要原料,氧化锂的电子式为_____________。
(3)近日华为宣布:利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出了石墨烯电池,电池反应式为LIxC6+Li1-x![]() C6+LiCoO2,其工作原理如图。
C6+LiCoO2,其工作原理如图。

①石墨烯的优点是提高电池的能量密度,石墨烯为层状结构,层与层之间存在的作用力是_______。
②锂离子电池不能用水溶液做离子导体的原因是___________(用离子方程式表示)。
③锂离子电池放电时正极的电极反应式为________________。
④请指出使用锂离子电池的注意问题____________________。(回答一条即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将100 mL 1 mol·L-1的氨水与100 mL a mol·L-1盐酸等体积混合,忽略反应放热和体积变化,下列有关推论不正确的是
A. 若混合后溶液pH=7,则c(NH4+)=c(Cl-)
B. 若a=2,则c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C. 若a=0.5,则c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D. 若混合后溶液满足c(H+)=c(OH-)+c(NH3·H2O),则可推出a=1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电解法可提纯含有某些含氧酸根杂质的粗KOH溶液,其工作原理如图所示。下列有关说法错误的是
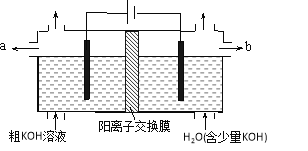
A. 通电后阴极区附近溶液pH会增大
B. 阳极反应式为4OH--4e-=2H2O+O2↑
C. 纯净的KOH溶液从b出口导出
D. K+通过交换膜从阴极区移向阳极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1 L密闭容器中,发生反应N2(g)+3H2(g)![]() 2NH3(g),若最初加入的N2和H2物质的量均为4 mol,测得10s内H2的平均速率v(H2)=0.12 molL-1s-1,则反应进行到10s时容器中N2的物质的量是
2NH3(g),若最初加入的N2和H2物质的量均为4 mol,测得10s内H2的平均速率v(H2)=0.12 molL-1s-1,则反应进行到10s时容器中N2的物质的量是
A.1.6molB.2.8molC.3.2molD.3.6mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酯类化合物与格氏试剂(RMgX,X=Cl、Br、I)的反应是合成叔醇类化合物的重要方法,可用于制备含氧多官能团化合物。化合物F合成路线如下,回答下列问题:
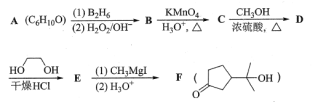
已知信息如下:
①RCH=CH2![]() RCH2CH2OH
RCH2CH2OH
②![]()
③RCOOCH3![]()
(1)A的结构简式为___,B→C的反应类型为__,C中官能团的名称为__,C→D的反应方程式为___。
(2)写出符合下列条件的D的同分异构体__(填结构简式,不考虑立体异构)。
①含有五元碳环结构;②能与NaHCO3溶液反应放出CO2;③能发生银镜反应。
(3)判断化合物F中有无手性碳原子,若有用“*”标出。__
(4)已知羟基能与格氏试剂发生反应。写出以![]() 、CH3OH和格氏试剂为原料制备
、CH3OH和格氏试剂为原料制备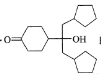 的合成路线(其它试剂任选)。__
的合成路线(其它试剂任选)。__
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com