
【题目】酯类化合物与格氏试剂(RMgX,X=Cl、Br、I)的反应是合成叔醇类化合物的重要方法,可用于制备含氧多官能团化合物。化合物F合成路线如下,回答下列问题:
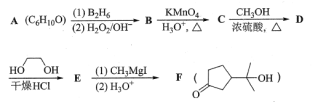
已知信息如下:
①RCH=CH2![]() RCH2CH2OH
RCH2CH2OH
②![]()
③RCOOCH3![]()
(1)A的结构简式为___,B→C的反应类型为__,C中官能团的名称为__,C→D的反应方程式为___。
(2)写出符合下列条件的D的同分异构体__(填结构简式,不考虑立体异构)。
①含有五元碳环结构;②能与NaHCO3溶液反应放出CO2;③能发生银镜反应。
(3)判断化合物F中有无手性碳原子,若有用“*”标出。__
(4)已知羟基能与格氏试剂发生反应。写出以![]() 、CH3OH和格氏试剂为原料制备
、CH3OH和格氏试剂为原料制备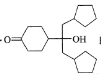 的合成路线(其它试剂任选)。__
的合成路线(其它试剂任选)。__
科目:高中化学 来源: 题型:
【题目】下图为元素周期表的另一种画法——塔式周期表,上面标有部分族及部分元素。请根据周期表中所列的元素回答问题:
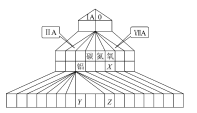
(1)碳、氮、氧三种元素的电负性由小到大的顺序为_____________________。
(2)Y3+的结构示意图为_____________,Z的价电子排布式为_______________。
(3)原子簇是由几个到几百个原子组成的相对独立的物质结构单元,如铝原子簇Al13、Al14。已知原子簇价电子总数为2,8,20,34,40,58……时,原子簇可稳定存在。
①Al13的化学性质与第__________族元素性质相似
②Al14达到稳定时,呈现的化合价为+2,其原因是___________________。
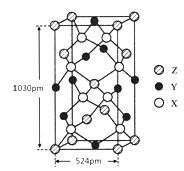
(4)某种化合物由X、Y、Z三种元素组成,其晶胞结构如图所示,则其化学式为____________,该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度:ρ=_______gcm-3(只要求列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类赖以生存的基础。回答下列问题:
(1)下列不属于新能源的是________(填字母)。
a.煤炭 b.太阳能 c.风能 d.地热能
(2)已知:
Ⅰ.H2(g)+![]() O2(g)=H2O(g) H1=-241.8kJmol-1
O2(g)=H2O(g) H1=-241.8kJmol-1
Ⅱ.H2(g)+![]() O2(g)=H2O(l) H2=-285.8kJmol-1
O2(g)=H2O(l) H2=-285.8kJmol-1
气态分子中的化学键 | 断开1 mol化学键所需的能量/kJ |
O-H | 465 |
O=O | 498 |
①氢气的燃烧热为________kJmol-1.
②断开1 mol H-H键需要吸收的能量为________kJ。
③36 g H2O(1)完全分解生成氧气和氧气,需要吸收________kJ的能量。
(3)金刚石和石墨为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时完全燃烧生成二氧化碳,反应中放出的热量如图所示。
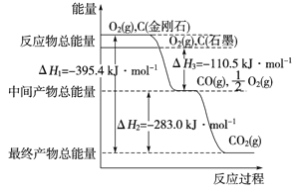
①在通常状况下,金刚石和石墨的稳定性较大的是________ (填“金刚石”或“石墨”)。
②12 g石墨在一定量空气中燃烧,生成36g气体,该过程放出的热量为________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用小粒径零价铁(ZVI)的电化学腐蚀处理三氯乙烯,进行水体修复的过程如图所示。H+,O2,NO3-等共存物的存在会影响水体修复效果,定义单位时间内ZVI释放电子的物质的量为nt,其中用于有效腐蚀的电子的物质的量为ne。下列说法错误的是( )

A. 反应①②③④均在正极发生
B. 单位时间内,三氯乙烯脱去amolCl时ne=amol
C. ④的电极反应式为NO3-+10H++8e-=NH4++3H2O
D. 增大单位体积水体中小粒径ZVI的投入量,可使nt增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乙烯醇生产过程中会产生大量副产物乙酸甲酯,其催化醇解反应可用于制备甲醇和乙酸己酯,该反应的化学方程式为:CH3COOCH3(l)+C6H13OH(l)![]() CH3COOC6H13(l)+CH3OH(l)
CH3COOC6H13(l)+CH3OH(l)
已知v正=k正x(CH3COOCH3)x(C6H13OH),v逆=k逆x(CH3COOC6H13)x(CH3OH),其中v正、v逆为正、逆反应速率,k正、k逆为速率常数,x为各组分的物质的量分数。
(1)反应开始时,已醇和乙酸甲酯按物质的量之比1:1投料,测得348K、343K、338K三个温度下乙酸甲酯转化率(α)随时间(t)的变化关系如图所示。
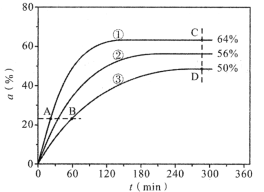
该醇解反应的ΔH____0(填>或<)。348K时,以物质的量分数表示的化学平衡常数Kx=____(保留2位有效数字)。在曲线①、②、③中,k正-k逆值最大的曲线是____;A、B、C、D四点中,v正最大的是___,v逆最大的是____。
(2)343K时,己醇和乙酸甲酯按物质的量之比1:1、1:2和2:1进行初始投料。则达到平衡后,初始投料比____时,乙酸甲酯转化率最大;与按1:2投料相比,按2:1投料时化学平衡常数Kx___(填增大、减小或不变)。
(3)该醇解反应使用离子交换树脂作催化剂,下列关于该催化剂的说法正确的是____。
a.参与了醇解反应,但并不改变反应历程 b.使k正和k逆增大相同倍数
c.降低了醇解反应的活化能 d.提高乙酸甲酯的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g) ![]() 2C(g)+2D(g)在四种不同情况下的反应速率分别为
2C(g)+2D(g)在四种不同情况下的反应速率分别为
①v(A)=0.45 mol·L-1·min-1 ②v(B)=0.6 mol·L-1·s-1 ③v(C)=0.4 mol·L-1·s-1 ④v(D)=0.45 mol·L-1·s-1,该反应进行的快慢顺序为
A. ④>③=②>① B. ④<③=②<① C. ①>②>③>④ D. ④>③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有下列六种物质的溶液:①氨水②NH4Cl③NaHSO4④醋酸⑤CH3COONa⑥NaHCO3。
①溶液呈酸性的是_______________(将相应的序号填入空格,下同)。
②溶液呈碱性的是______________。
③能促进水电离的是______________。
④能抑制水电离的是______________。
(2)FeCl3水解的离子方程式为___________________。改变下列条件:①升高温度②加入少量浓盐酸③加水稀释④加少量铁粉⑤加少量NaHCO3(s)。
①使水解平衡右移的是___________。
②使水解平衡左移的是___________。
③使溶液pH减小的是_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结晶玫瑰是具有玫瑰香气的香料,可由下列方法合成(部分反应物及反应条件未标出)

已知: ![]() (-R表示烃基)
(-R表示烃基)
(1)A是苯的一种同系物,相同条件下,其蒸气对氢气的相对密度是46,则A的名称是__________。
(2)反应②所需药品及反应条件是_________________。
(3)C的核磁共振氢谱峰面积之比是_________。
(4)C有多种同分异构体,其中属于芳香族化合物的有________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据要求填空。
(1)在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:
①当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是________。
②同体积、同PH的三种酸,中和NaOH的能力由大到小的顺序是________。
③将PH相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是________。
(2)已知:Ksp(AgBr)=7.7×10-13,Ksp(AgSCN)=1×10-12;AgBr(s)+SCN-(aq)![]() AgSCN(s)+Br-(aq)的平衡常数____________。
AgSCN(s)+Br-(aq)的平衡常数____________。
(3)已知NH4A溶液为中性,又知将HA溶液加入Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH________7(填“<”、“>”或“=”);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序是________________(填序号)。
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
(4)在室温下,有下列四种溶液:①NH4Cl②CH3COONH4③NH4HSO4④NH3·H2O,若c(NH4+)相等,则四种溶液的浓度由大到小的排列顺序是__________(填序号)。
(5)某二元弱酸H2A,已知:Ka1=1.54×10-2,Ka2=1.02×10-7;NaHA溶液显________性,原因是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com