
【题目】聚乙烯醇生产过程中会产生大量副产物乙酸甲酯,其催化醇解反应可用于制备甲醇和乙酸己酯,该反应的化学方程式为:CH3COOCH3(l)+C6H13OH(l)![]() CH3COOC6H13(l)+CH3OH(l)
CH3COOC6H13(l)+CH3OH(l)
已知v正=k正x(CH3COOCH3)x(C6H13OH),v逆=k逆x(CH3COOC6H13)x(CH3OH),其中v正、v逆为正、逆反应速率,k正、k逆为速率常数,x为各组分的物质的量分数。
(1)反应开始时,已醇和乙酸甲酯按物质的量之比1:1投料,测得348K、343K、338K三个温度下乙酸甲酯转化率(α)随时间(t)的变化关系如图所示。
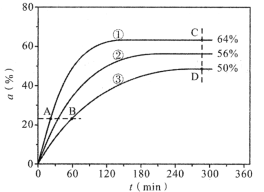
该醇解反应的ΔH____0(填>或<)。348K时,以物质的量分数表示的化学平衡常数Kx=____(保留2位有效数字)。在曲线①、②、③中,k正-k逆值最大的曲线是____;A、B、C、D四点中,v正最大的是___,v逆最大的是____。
(2)343K时,己醇和乙酸甲酯按物质的量之比1:1、1:2和2:1进行初始投料。则达到平衡后,初始投料比____时,乙酸甲酯转化率最大;与按1:2投料相比,按2:1投料时化学平衡常数Kx___(填增大、减小或不变)。
(3)该醇解反应使用离子交换树脂作催化剂,下列关于该催化剂的说法正确的是____。
a.参与了醇解反应,但并不改变反应历程 b.使k正和k逆增大相同倍数
c.降低了醇解反应的活化能 d.提高乙酸甲酯的平衡转化率
【答案】> 3.2 ① A C 2:1 不变 bc
【解析】
(1)根据图像,①的速率最快,说明①对应的是最高温度348K,温度升高,平衡时转化率增大,说明正向是吸热的,所以ΔH>0;348K时,设初始投入为1mol,则有:

带入平衡常数表达式:Kx=χ(CH3COOC6H13) χ(CH3OH) / [χ(CH3COOCH3) χ(C6H13OH)] = 0.32×0.32 / (0.18×0.18) = 3.2;k正、k逆是温度的函数,根据平衡移动的规律,k正受温度影响更大,因此温度升高,k正增大的程度大于k逆,因此,k正-k逆值最大的曲线是①;根据v正= k正χ(CH3COOCH3)χ(C6H13OH),v逆= k逆χ(CH3COO C6H13)χ(CH3OH),A点χ(CH3COOCH3)χ(C6H13OH)大,温度高,因此A点v正最大;C点χ(CH3COO C6H13)χ(CH3OH)大且温度高,因此C点v逆最大;故答案为:>;3.2;①;A;C;
(2)增大己醇的投入量,可以增大乙酸甲酯转化率,因此,2:1时乙酸甲酯转化率最大;化学平衡常数Kx只与温度有关,因此不变;故答案为:2:1;不变;
(3)催化剂参与了醇解反应,改变了反应历程,a错误;
催化剂不影响化学平衡,说明催化剂使k正和k逆增大相同倍数,b正确;
催化剂能够降低反应的活化能,c正确;
催化剂不改变化学平衡,d错误;
故答案为:bc。


科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了三位为锂离子电池发展做出巨大贡献的科学家,锂离子电池广泛应用于手机、笔记本电脑等。
(1)锂元素在元素周期表中的位置:_________________。
(2)氧化锂(Li2O)是制备锂离子电池的重要原料,氧化锂的电子式为_____________。
(3)近日华为宣布:利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出了石墨烯电池,电池反应式为LIxC6+Li1-x![]() C6+LiCoO2,其工作原理如图。
C6+LiCoO2,其工作原理如图。

①石墨烯的优点是提高电池的能量密度,石墨烯为层状结构,层与层之间存在的作用力是_______。
②锂离子电池不能用水溶液做离子导体的原因是___________(用离子方程式表示)。
③锂离子电池放电时正极的电极反应式为________________。
④请指出使用锂离子电池的注意问题____________________。(回答一条即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将含有0.4 mol CuSO4和0.1 mol NaCl的水溶液用惰性电极电解一段时间后,若在一个电极上得到6.4g Cu,则另一电极上生成气体(在标准状况)的体积为
A.1.12 LB.1.68 LC.2.24 LD.3.36L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。马蒂逊(Mathieson)法制备亚氯酸钠的流程如下:
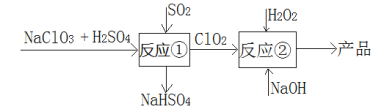
下列说法错误的是( )
A.反应①阶段,参加反应的NaClO3和SO2的物质的量之比为2:1
B.若反应①通过原电池来实现,则ClO2是正极产物
C.反应②中的H2O2可用NaClO4代替
D.反应②条件下,ClO2的氧化性大于H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mL0.1mol·L-1NaOH溶液中加入0.1mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是( )

A.b点所示溶液中[A-]>[HA]
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,[Na+]=[A-]+[HA]
D.a点所示溶液中[Na+]>[A-]>[H+]>[HA]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酯类化合物与格氏试剂(RMgX,X=Cl、Br、I)的反应是合成叔醇类化合物的重要方法,可用于制备含氧多官能团化合物。化合物F合成路线如下,回答下列问题:
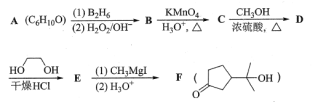
已知信息如下:
①RCH=CH2![]() RCH2CH2OH
RCH2CH2OH
②![]()
③RCOOCH3![]()
(1)A的结构简式为___,B→C的反应类型为__,C中官能团的名称为__,C→D的反应方程式为___。
(2)写出符合下列条件的D的同分异构体__(填结构简式,不考虑立体异构)。
①含有五元碳环结构;②能与NaHCO3溶液反应放出CO2;③能发生银镜反应。
(3)判断化合物F中有无手性碳原子,若有用“*”标出。__
(4)已知羟基能与格氏试剂发生反应。写出以![]() 、CH3OH和格氏试剂为原料制备
、CH3OH和格氏试剂为原料制备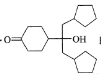 的合成路线(其它试剂任选)。__
的合成路线(其它试剂任选)。__
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2 mol SO2和1 mol O2充入一容积固定的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g) ![]() 2SO3(g),下列物理量不再改变时,并不能说明化学反应已达到平衡状态的是( )
2SO3(g),下列物理量不再改变时,并不能说明化学反应已达到平衡状态的是( )
A. 混合气体的密度
B. 混合气体的压强
C. 混合气体的总物质的量
D. 混合气体的平均相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BPA的结构简式如右下图所示,常用来生产防碎塑料聚碳酸酯。

(1)该物质的分子式为___________,含氧官能团的名称是_________,属于____类。
(2)该物质最多_____个碳原子共面。
(3)充分燃烧0.1mol该有机物,消耗的O2在标准状况下的体积为_________。
(4)下列关于BPA的叙述中,不正确的是_______。
A.可以发生还原反应
B.遇FeCl3溶液紫色
C.1mol该有机物最多可与2molH2反应
D.可与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年12月1日国际纯粹与应用化学联合会宣布,将合成的四种新元素命名为113号![]() 缩写为
缩写为![]() 、115号
、115号![]() 、117号
、117号![]() 和118号
和118号![]() 则下列说法不正确的是
则下列说法不正确的是
A.113号元素的氧化物为碱性氧化物
B.115号元素位于第七周期VA族
C.含176个中子的Ts原子表示为![]()
D.118号元素的原子最外层有8个电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com