
【题目】将含有0.4 mol CuSO4和0.1 mol NaCl的水溶液用惰性电极电解一段时间后,若在一个电极上得到6.4g Cu,则另一电极上生成气体(在标准状况)的体积为
A.1.12 LB.1.68 LC.2.24 LD.3.36L
【答案】B
【解析】
电解CuSO4和NaCl混合溶液时,阴极上Cu2+先放电,然后H+放电,阳极上Cl-先放电,然后OH-放电,若在一个电极上得到6.4g的Cu,其物质的量是6.4g÷64g/mol=0.1mol<0.4mol,说明Cu未反应完全,反应转移电子的物质的量是0.1mol×2=0.2mol,阳极上0.1molCl-放电,2Cl--2e-=Cl2↑,Cl-转移电子的物质的量=0.1mol×1=0.1mol<0.2mol,因此阳极上还有OH-离子放电,转移0.1mol电子,4OH--4e-=2H2O+O2↑,转移0.1mol电子生成O2的物质的量是n(O2)=![]() n(e-)=
n(e-)=![]() ×0.1mol=0.025mol,产生Cl2的物质的量n(Cl2)=
×0.1mol=0.025mol,产生Cl2的物质的量n(Cl2)=![]() ×0.1mol=0.05mol,所以反应产生气体的物质的量是0.05mol+0.025mol=0.075mol,则产生气体在标准状况的体积V=0.075mol×22.4L/mol=1.68L,故合理选项是B。
×0.1mol=0.05mol,所以反应产生气体的物质的量是0.05mol+0.025mol=0.075mol,则产生气体在标准状况的体积V=0.075mol×22.4L/mol=1.68L,故合理选项是B。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】设NA 为阿伏加德罗常数的值,下列说法正确的是( )
A.1mol SiO2 所含Si-O键的数目为 2 NA
B.常温下,1 L pH=9的CH3COONa 溶液中由水电离的H+ 数目为 10-9 NA
C.40 mL 10 mol/L浓盐酸与足量MnO2充分反应,生成的氯气分子数为 0.1NA
D.标准状况下,11.2 L 甲烷和乙烯混合物中含氢原子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时CH3COOH的电离常数K=1.6×10-5。该温度下向20ml0.01mol/L CH3COOH溶液中逐滴加入0.01mol/LKOH溶液,其pH变化曲线如图所示(忽略温度和溶液体积的变化),下列说法正确的是( )
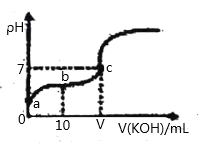
A.a点溶c(H+)为4.0×10-5mol/L
B.b点溶液中满足c(CH3COO-) +c(OH-)=c(CH3COOH)+c(H+)
C.V=20
D.滴定过程中,c(CH3COO-)+c(CH3COOH)+c(K+)=0.01mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. 稀硫酸溶液与氢氧化钡溶液恰好中和: Ba2++OH﹣+H++SO42﹣=BaSO4↓+H2O
B. 金属钠投入硫酸镁溶液中: 2Na+2H2O +Mg2+=2Na++H2↑+Mg(OH)2↓
C. 碳酸钠溶液中通入过量氯气: CO32﹣+Cl2=CO2↑+Cl-+ClO-
D. 实验室用 MnO2 和浓盐酸制取 Cl2: MnO2+4HCl(浓) ![]() Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(乙二酸)存在于自然界的植物中。草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O4·2H2O)无色,熔点为101 ℃,易溶于水,受热脱水、升华,170 ℃以上分解。回答下列问题:

(1)装置C中可观察到的现象是_________________________________,装置B的主要作用是________。
(2)请设计实验验证草酸的酸性比碳酸强____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类赖以生存的基础。回答下列问题:
(1)下列不属于新能源的是________(填字母)。
a.煤炭 b.太阳能 c.风能 d.地热能
(2)已知:
Ⅰ.H2(g)+![]() O2(g)=H2O(g) H1=-241.8kJmol-1
O2(g)=H2O(g) H1=-241.8kJmol-1
Ⅱ.H2(g)+![]() O2(g)=H2O(l) H2=-285.8kJmol-1
O2(g)=H2O(l) H2=-285.8kJmol-1
气态分子中的化学键 | 断开1 mol化学键所需的能量/kJ |
O-H | 465 |
O=O | 498 |
①氢气的燃烧热为________kJmol-1.
②断开1 mol H-H键需要吸收的能量为________kJ。
③36 g H2O(1)完全分解生成氧气和氧气,需要吸收________kJ的能量。
(3)金刚石和石墨为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时完全燃烧生成二氧化碳,反应中放出的热量如图所示。
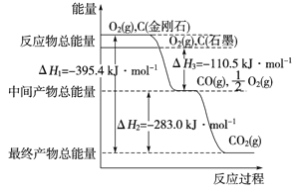
①在通常状况下,金刚石和石墨的稳定性较大的是________ (填“金刚石”或“石墨”)。
②12 g石墨在一定量空气中燃烧,生成36g气体,该过程放出的热量为________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取金属镁的工艺流程可简单图示如下:

(1)步骤①的目的是将海水中的Mg2+沉淀为Mg(OH)2,若浓缩海水中c(Mg2+)=2.0 mol·L-1,Mg2+开始形成沉淀时溶液的pH约为________(已知Ksp[Mg(OH)2]=1.8×10-11,log3=0.48)
(2)步骤③的操作由蒸发浓缩,______,过滤,_______四个环节组成。
(3)步骤④是在HCl气流中加热晶体得到无水MgCl2,简要说明HCl气体的作用_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乙烯醇生产过程中会产生大量副产物乙酸甲酯,其催化醇解反应可用于制备甲醇和乙酸己酯,该反应的化学方程式为:CH3COOCH3(l)+C6H13OH(l)![]() CH3COOC6H13(l)+CH3OH(l)
CH3COOC6H13(l)+CH3OH(l)
已知v正=k正x(CH3COOCH3)x(C6H13OH),v逆=k逆x(CH3COOC6H13)x(CH3OH),其中v正、v逆为正、逆反应速率,k正、k逆为速率常数,x为各组分的物质的量分数。
(1)反应开始时,已醇和乙酸甲酯按物质的量之比1:1投料,测得348K、343K、338K三个温度下乙酸甲酯转化率(α)随时间(t)的变化关系如图所示。
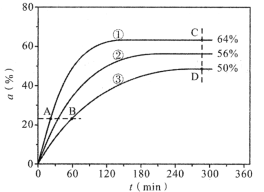
该醇解反应的ΔH____0(填>或<)。348K时,以物质的量分数表示的化学平衡常数Kx=____(保留2位有效数字)。在曲线①、②、③中,k正-k逆值最大的曲线是____;A、B、C、D四点中,v正最大的是___,v逆最大的是____。
(2)343K时,己醇和乙酸甲酯按物质的量之比1:1、1:2和2:1进行初始投料。则达到平衡后,初始投料比____时,乙酸甲酯转化率最大;与按1:2投料相比,按2:1投料时化学平衡常数Kx___(填增大、减小或不变)。
(3)该醇解反应使用离子交换树脂作催化剂,下列关于该催化剂的说法正确的是____。
a.参与了醇解反应,但并不改变反应历程 b.使k正和k逆增大相同倍数
c.降低了醇解反应的活化能 d.提高乙酸甲酯的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把Ca(OH)2放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s) ![]() Ca2+(aq)+2OH-(aq)。下列说法正确的是( )
Ca2+(aq)+2OH-(aq)。下列说法正确的是( )
A.恒温下向溶液中加入CaO,溶液的pH升高
B.给溶液加热,溶液的pH升高
C.向溶液中加入Na2CO3溶液,其中固体质量增加
D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com