
【题目】从海水中提取金属镁的工艺流程可简单图示如下:

(1)步骤①的目的是将海水中的Mg2+沉淀为Mg(OH)2,若浓缩海水中c(Mg2+)=2.0 mol·L-1,Mg2+开始形成沉淀时溶液的pH约为________(已知Ksp[Mg(OH)2]=1.8×10-11,log3=0.48)
(2)步骤③的操作由蒸发浓缩,______,过滤,_______四个环节组成。
(3)步骤④是在HCl气流中加热晶体得到无水MgCl2,简要说明HCl气体的作用_________。
【答案】8.48 降温结晶 (冷却结晶也行) 洗涤干燥 抑制MgCl2水解,防止生成Mg(OH)Cl[或Mg(OH)2]
【解析】
(1)向含有MgCl2的海水中加入生石灰,Mg2+转化为Mg(OH)2沉淀,根据溶度积常数的含义计算Mg2+开始形成沉淀时OH-的浓度,再结合水的离子积常数计算溶液的pH;
(2)根据MgCl2的溶解度受温度的影响变化较大的性质分析解答;
(3)根据盐的水解规律分析。
Ksp[Mg(OH)2]=1.8×10-11,c(Mg2+)=2.0 mol/L,则c2(OH-)=1.8×10-11÷2.0=9×10-12,所以c(OH-)=3×10-6mol/L,由于在室温下水的离子积为Kw=1×10-14,则c(H+)=1×10-14÷3×10-6=![]() ×10-8mol/L,pH=-lgc(H+)=-lg
×10-8mol/L,pH=-lgc(H+)=-lg![]() ×10-8=8+0.48=8.48;
×10-8=8+0.48=8.48;
(2)步骤③是从MgCl2溶液中获得MgCl26H2O,由于MgCl2的溶解度受温度的影响变化较大,所以操作由蒸发浓缩,冷却结晶,过滤,洗涤干燥四个环节组成;
(3)氯化镁晶体加热,MgCl2会溶解在结晶水中,形成溶液,由于MgCl2是强酸弱碱盐,在溶液中发生水解反应产生Mg(OH)2或Mg(OH)Cl和HCl,HCl挥发,导致最后得到的是Mg(OH)2,根据盐的水解规律,在HCl气氛中加热,就可以抑制盐的水解,防止生成Mg(OH)Cl[或Mg(OH)2]。


科目:高中化学 来源: 题型:
【题目】如图所示为元素周期表的一部分,其中X、Y、Z、W为四种短周期元素。Z元素原子核外K层与M层上的电子数相等。下列说法中正确的是( )
![]()
A. Y元素的最高价氧化物对应的水化物的化学式为H3YO4
B. Y的最简单气态氢化物的水溶液显弱碱性
C. 原子半径由小到大的顺序为X<Z<Y<W
D. X、Z两种元素的氧化物中所含化学键的类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
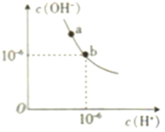
(1)某温度(t℃)时,水的电离图象如下图所示,a点水的离子积Kw=_____该温度下,pH=11的NaOH溶液与pH=2的H2SO4溶液等体积混合,溶液显_____(填“酸”或“碱”)性。
(2)25℃时,向0.1molL-1的氨水中加入少量NH4Cl固体,当固体溶解后,测得溶液pH_____(填“增大”“减小”或“不变”,下同),![]() 的物质的量浓度_____
的物质的量浓度_____
(3)将体积相等的NaOH稀溶液和CH3COOH溶液混合,若溶液中c(Na+)=c(CH3COO-),则该溶液显_____(填“酸性”“碱性”或“中性”),则混合前c(NaOH)_____(填“>”“<”或“=”)c(CH3COOH)
(4)常温下,Ksp[Fe(OH)3]=1×10-38,要使溶液中的Fe3+沉淀完全[残留在溶液中的c(Fe3+)<10-5molL-1],则溶液的pH应大于_____
(5)用可溶性碳酸盐,可以浸取CaSO4固体,在溶液浸取过程中会发生反应:CaSO4(s)+![]() (ag)CaCO3(s)+
(ag)CaCO3(s)+![]() (aq)。已知:298K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,则此温度下该反应的平衡常数K为_____(计算结果保留三位有效数字)。
(aq)。已知:298K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,则此温度下该反应的平衡常数K为_____(计算结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.若将12.8gCu跟足量的浓硝酸反应,铜消耗完时,
(1)产生气体的体积为___(标准状况,不考虑NO2转化成N2O4)。
(2)该反应转移的电子总数为___。
(3)铜与浓硝酸反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】只用一种试剂鉴别![]() 、CH3CH2OH、CH3CH2Br三种无色液体,下列试剂不能实现的是
、CH3CH2OH、CH3CH2Br三种无色液体,下列试剂不能实现的是
A.Br2的CCl4溶液B.溴水C.酸性高锰酸钾溶液D.FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜是一种无机精细化工产品,实验室用蚀刻废液![]() 主要含
主要含![]() 、HCl等
、HCl等![]() 制备CuCl的实验流程如下.
制备CuCl的实验流程如下.

![]() 滤渣1的主要成分为 ______ ;还原时生成
滤渣1的主要成分为 ______ ;还原时生成![]() 的离子方程式为 ______ .
的离子方程式为 ______ .
![]() 加水时发生反应的离子方程式为 ______
加水时发生反应的离子方程式为 ______ ![]() 过滤时用的硅酸盐质仪器除烧杯外还有 ______
过滤时用的硅酸盐质仪器除烧杯外还有 ______ ![]() 滤液2的用途是 ______ .
滤液2的用途是 ______ .
![]() 用稀盐酸洗涤的目的是 ______ .
用稀盐酸洗涤的目的是 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
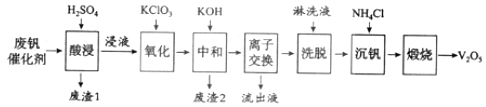
【题目】以硅藻土为载体的五氧化二钒![]() 是接触法生成硫酸的催化剂。从废钒催化剂中回收
是接触法生成硫酸的催化剂。从废钒催化剂中回收![]() 既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 |
|
|
|
|
|
|
质量分数 |
|
|
|
|
|
|
以下是一种废钒催化剂回收工艺路线:
回答下列问题:
![]() 五氧化二钒是一种催化剂,可将
五氧化二钒是一种催化剂,可将![]() 转化为
转化为![]() ,请写出该反应的化学方程式______。
,请写出该反应的化学方程式______。
![]() “酸浸”时
“酸浸”时![]() 转化为
转化为![]() ,反应的离子方程式为______,同时
,反应的离子方程式为______,同时![]() 转成
转成![]() “废渣1”的主要成分是______。
“废渣1”的主要成分是______。
![]() “氧化”中欲使3mol的
“氧化”中欲使3mol的![]() 变为
变为![]() ,则需要氧化剂
,则需要氧化剂![]() 至少为______mol。
至少为______mol。
![]() “中和”作用之一是使钒以
“中和”作用之一是使钒以![]() 形式存在于溶液中。“废渣2”中含有______。
形式存在于溶液中。“废渣2”中含有______。
![]() “流出液”中阳离子最多的是______。
“流出液”中阳离子最多的是______。
![]() “沉钒”得到偏钒酸铵
“沉钒”得到偏钒酸铵![]() 沉淀,写出“煅烧”中发生反应的化学方程式______。
沉淀,写出“煅烧”中发生反应的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向AgCl浊液中滴加氨水后可得到澄清溶液,继续滴加浓硝酸后又有沉淀生成。经查资料得知:Ag++ 2NH3·H2O![]() Ag(NH3)2+ 2H2O。下列分析不正确的是
Ag(NH3)2+ 2H2O。下列分析不正确的是
A. 浊液中存在沉淀溶解平衡:AgCl (s)![]() Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)
B. 实验可以证明NH3结合Ag+能力比Cl-强
C. 实验表明实验室可用氨水洗涤银镜反应后的试管
D. 由资料信息可推知:加浓硝酸后生成的沉淀为AgCl
查看答案和解析>>
科目:高中化学 来源: 题型:
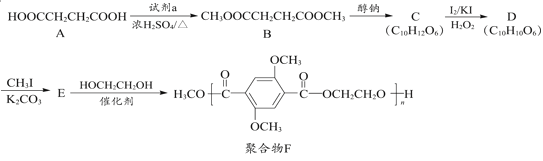
【题目】有机物A是一种重要的化工原料,用A制取新型聚合物F的合成路线如图:
已知:
ⅰ.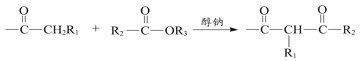 +R3OH
+R3OH
ⅱ.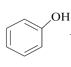 +R1I
+R1I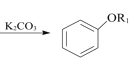 +HI
+HI
ⅲ.R1COOR2+R3OH![]() R1COOR3+R2OH
R1COOR3+R2OH
回答下列问题:
(1)A中官能团的结构简式为___。
(2)试剂a的名称___。1molD与足量的氢氧化钠溶液反应所需氢氧化钠的物质的量___。
(3)C中含有一个六元环,C的结构简式为___。
(4)C→D的反应类型为___。
(5)E→F的化学方程式是___。
(6)下列说法正确的是___(填序号)。
a.A能与NaHCO3溶液反应
b.醇钠可由醇与氢氧化钠反应制得
c.用FeCl3溶液不能鉴别D和E
d.HOCH2CH2OH俗称甘油
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com