
【题目】以硅藻土为载体的五氧化二钒![]() 是接触法生成硫酸的催化剂。从废钒催化剂中回收
是接触法生成硫酸的催化剂。从废钒催化剂中回收![]() 既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 |
|
|
|
|
|
|
质量分数 |
|
|
|
|
|
|
以下是一种废钒催化剂回收工艺路线:
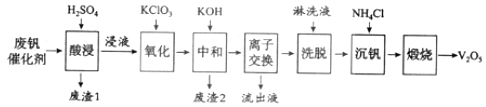
回答下列问题:
![]() 五氧化二钒是一种催化剂,可将
五氧化二钒是一种催化剂,可将![]() 转化为
转化为![]() ,请写出该反应的化学方程式______。
,请写出该反应的化学方程式______。
![]() “酸浸”时
“酸浸”时![]() 转化为
转化为![]() ,反应的离子方程式为______,同时
,反应的离子方程式为______,同时![]() 转成
转成![]() “废渣1”的主要成分是______。
“废渣1”的主要成分是______。
![]() “氧化”中欲使3mol的
“氧化”中欲使3mol的![]() 变为
变为![]() ,则需要氧化剂
,则需要氧化剂![]() 至少为______mol。
至少为______mol。
![]() “中和”作用之一是使钒以
“中和”作用之一是使钒以![]() 形式存在于溶液中。“废渣2”中含有______。
形式存在于溶液中。“废渣2”中含有______。
![]() “流出液”中阳离子最多的是______。
“流出液”中阳离子最多的是______。
![]() “沉钒”得到偏钒酸铵
“沉钒”得到偏钒酸铵![]() 沉淀,写出“煅烧”中发生反应的化学方程式______。
沉淀,写出“煅烧”中发生反应的化学方程式______。
【答案】![]()
![]()
![]()
![]()
![]() 、
、![]()
![]()
![]()
【解析】
从废钒催化剂中回收![]() ,由流程可知,“酸浸”时
,由流程可知,“酸浸”时![]() 转化为
转化为![]() ,
,![]() 转成
转成![]() 氧化铁、氧化铝均转化为金属阳离子,只有
氧化铁、氧化铝均转化为金属阳离子,只有![]() 不溶,则过滤得到的滤渣1为
不溶,则过滤得到的滤渣1为![]() ,然后加氧化剂
,然后加氧化剂![]() ,将
,将![]() 变为
变为![]() ,再加KOH时,铁离子、铝离子转化为
,再加KOH时,铁离子、铝离子转化为![]() 、
、![]() 沉淀,同时中和硫酸,过滤得到的滤渣2为
沉淀,同时中和硫酸,过滤得到的滤渣2为![]() 、
、![]() ,“离子交换”和“洗脱”可简单表示为:
,“离子交换”和“洗脱”可简单表示为:![]()
![]()
![]() ,由ROH为强碱性阴离子交换树脂可知,碱性条件下利用反应逆向移动,流出液中主要为硫酸钾,“沉钒”得到偏钒酸铵
,由ROH为强碱性阴离子交换树脂可知,碱性条件下利用反应逆向移动,流出液中主要为硫酸钾,“沉钒”得到偏钒酸铵![]() 沉淀,“煅烧”时分解生成
沉淀,“煅烧”时分解生成![]() ,以此解答该题。
,以此解答该题。
![]() 五氧化二钒是一种催化剂,可将
五氧化二钒是一种催化剂,可将![]() 转化为
转化为![]() ,该反应的化学方程式
,该反应的化学方程式![]() ,故答案为:
,故答案为:![]() ;
;
![]() “酸浸”时
“酸浸”时![]() 转成
转成![]() ,反应的离子方程式为
,反应的离子方程式为![]() ,由上述分析可知“废渣1”的主要成分是
,由上述分析可知“废渣1”的主要成分是![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
![]() “氧化”的目的是使
“氧化”的目的是使![]() 变为
变为![]() ,V元素的化合价由
,V元素的化合价由![]() 价升高为
价升高为![]() 价,Cl元素的化合价由
价,Cl元素的化合价由![]() 价降低为
价降低为![]() 价,由电子守恒可知该反应中氧化剂和还原剂的物质的量之比为1:6,则欲使3mol的
价,由电子守恒可知该反应中氧化剂和还原剂的物质的量之比为1:6,则欲使3mol的![]() 变为
变为![]() ,则需要氧化剂
,则需要氧化剂![]() 至少为
至少为![]() ,故答案为:
,故答案为:![]() ;
;
![]() “中和”步骤有2个目的,
“中和”步骤有2个目的,![]() 是使钒以
是使钒以![]() 形式存在于溶液中;
形式存在于溶液中;![]() 沉淀
沉淀![]() 、
、![]() ,生成
,生成![]() 、
、![]() ,故答案为:
,故答案为:![]() 、
、![]() ;
;
![]() “流出液”主要成分为
“流出液”主要成分为![]() ,阳离子最多的是
,阳离子最多的是![]() ,故答案为:
,故答案为:![]() ;
;
![]() “沉钒”得到偏钒酸铵
“沉钒”得到偏钒酸铵![]() 沉淀,“煅烧”中发生反应的化学方程式为
沉淀,“煅烧”中发生反应的化学方程式为![]() ,故答案为:
,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】已知:Cu(s)+2H+(aq)===Cu2+(aq)+H2(g) ΔH1
2H2O2(l)===2H2O(l)+O2(g) ΔH2
2H2(g)+O2(g)===2H2O(l) ΔH3
则反应Cu(s)+H2O2(l)+2H+(aq)===Cu2+(aq)+2H2O(l)的ΔH是
A. ΔH=ΔH1+1/2ΔH2+1/2ΔH3 B. ΔH=ΔH1+1/2ΔH2-1/2ΔH3
C. ΔH=ΔH1+2ΔH2+2ΔH3 D. ΔH=2ΔH1+ΔH2+ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列问题,与盐类水解有关的是
①NH4Cl与ZnCl2溶液可作焊接金属时的除锈剂
②NaHCO3与Al2(SO4)3两种溶液用于制造泡沫灭火器
③将含有CaSO4的水垢用Na2 CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3
④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞
⑤加热蒸干AlCl3溶液得到Al(OH)3固体
A. ①②⑤ B. ②③④ C. ①②④⑤ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取金属镁的工艺流程可简单图示如下:

(1)步骤①的目的是将海水中的Mg2+沉淀为Mg(OH)2,若浓缩海水中c(Mg2+)=2.0 mol·L-1,Mg2+开始形成沉淀时溶液的pH约为________(已知Ksp[Mg(OH)2]=1.8×10-11,log3=0.48)
(2)步骤③的操作由蒸发浓缩,______,过滤,_______四个环节组成。
(3)步骤④是在HCl气流中加热晶体得到无水MgCl2,简要说明HCl气体的作用_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制硫酸的反应原理主要有下列三个反应:
①FeS2(s)+O2(g)![]() Fe2O3(s)+SO2(g);ΔH1
Fe2O3(s)+SO2(g);ΔH1
②2SO2(g)+O2(g)![]() 2SO3(g); ΔH2
2SO3(g); ΔH2
③SO3+H2O=H2SO4
Ⅰ.(1)反应①配平后各物质系数分别为_____、______、_______、______。若每生成1molSO2时反应放热426.5kJ,则ΔH1=_______________。
(2)工业生产中将FeS2矿石粉碎后投入反应器中反应,这样做的目的是___________。
Ⅱ.下表是不同温度和压强下反应②中SO2的转化率
0.1Mp | 0.5Mp | 1Mp | 10Mp | |
400℃ | 99.2 | 99.6 | 99.7 | 99.9 |
500℃ | 93.5 | 96.9 | 97.8 | 99.3 |
600℃ | 73.7 | 85.8 | 89.5 | 96.4 |
(3)反应②是气体体积缩小的可逆反应,增大压强有利于提高原料转化率,但工业生产中该反应在常压下进行,采用常压生产条件的理由是_______________________。
(4)若原料气组成:SO2 7%,O211%,N2 82%,在温度和压强不变的条件下,混合气体体积变为原来的97.2%,则SO2的转化率为_________。
Ⅲ.尾气中的二氧化硫对环境造成污染,需要处理后才能排放。常用亚硫酸钠吸收法。
(5)Na2SO3溶液吸收SO2的离子方程式为________________________ ;
(6)常温下,当吸收至pH=6时,吸收液中相关离子浓度关系一定正确的是____(填序号)
A.c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c(OH-)
B.c(Na+)=c(SO32-)+c(HSO3-)+C(H2SO3)
C.c(Na+)>c(SO32-)>c(OH-)>c(H+)
D.水电离出c(OH-)=l×l0-8 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示的原电池,下列说法正确的是( )
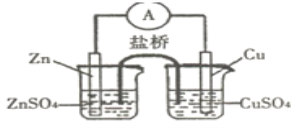
A.电子从锌电极通过电流表流向铜电极
B.盐桥中的阳离子向硫酸锌溶液中迁移
C.锌电极发生氧化反应,铜电极发生还原反应,其电极反应是2H+2e=H2↑
D.取出盐桥后,电流表仍会偏转,铜电极在反应前后质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于H2S叙述不正确的是( )
A. H2S热稳定性差,在加热条件下会分解为硫单质与氢气
B. 部分金属硫化物不溶于酸,将硫化氢通入CuSO4、FeSO4等溶液中会出现黑色沉淀
C. H2S具有毒性,可以用湿润的醋酸铅试纸检验H2S
D. 久置的氢硫酸溶液易变质,是因为H2S具有很强的还原性,被空气中的O2氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某化学兴趣小组设计了一个燃料电池,并探究氯碱工业原理和粗铜精炼原理,其中乙装置中X为阳离子交换膜。根据要求回答相关问题:

(1)通入氧气的电极为_____(填“正极”或“负极”),通氢气一极的电极反应式为_________________;
(2)铁电极为_______(填“阳极”或“阴极”),乙装置中电解反应的化学方程式为_________________。
(3)若在标准状况下,有1.12 L氧气参加反应,丙装置中阴极增重的质量为______g;
(4)某粗铜中含有铁、金、银和铂等杂质,通过电解精制后,为从电解液中制得硫酸铜晶体(CuSO4·5H2O),设计了如下工艺流程:

已知:几种金属阳离子开始沉淀和沉淀完全的pH:
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Fe3+ | 1.9 | 3.2 |
Fe2+ | 7.0 | 9.0 |
Cu2+ | 4.7 | 6.7 |
①步骤I中加入试剂A的目的是_____________________________,试剂A应选择______(填序号);
a.氯气 b.过氧化氢 C.酸性高锰酸钾溶液
选择该试剂的原因_____________________________________________________;
②步骤II中试剂B为_________,调节pH的范围是___________;
③步骤III的操作是加热浓缩、_______、___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某高能锂离子电池的总反应为:2Li+FeS= Fe +Li2S,电解液为含LiPF6.SO(CH3)2的有机溶液(Li+可自由通过)。某小组以该电池为电源电解废水并获得单质镍,工作原理如图所示。

下列分析正确的是
A. 该锂离子电池正极反应为FeS+2Li++2e-=Fe +Li2S
B. X与电池的Li电极相连
C. 电解过程中c(BaC12)保持不变
D. 若去掉阳离子膜将左右两室合并,则X电极的反应不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com