
【题目】设NA 为阿伏加德罗常数的值,下列说法正确的是( )
A.1mol SiO2 所含Si-O键的数目为 2 NA
B.常温下,1 L pH=9的CH3COONa 溶液中由水电离的H+ 数目为 10-9 NA
C.40 mL 10 mol/L浓盐酸与足量MnO2充分反应,生成的氯气分子数为 0.1NA
D.标准状况下,11.2 L 甲烷和乙烯混合物中含氢原子数目为2NA
【答案】D
【解析】
A.在SiO2晶体中每个Si原子形成4个Si-O键,则1mol SiO2 所含Si-O键的数目为4 NA,故A错误;
B.CH3COONa属于强碱弱酸盐,CH3COO-的水解促进水的电离,常温下,1 L pH=9的CH3COONa 溶液中c(H+)电离=c(OH-)=1×10-5mol/L,发生电离的水分子物质的量为1×10-5mol/L×1L=1×10-5mol,即由水电离的H+ 数目为 10-5 NA,故B错误;
C.40 mL 10 mol/L浓盐酸与足量MnO2充分反应的过程中,盐酸的浓度降低到一定浓度,反应会停止,即溶液中0.4molHCl未能完全参加反应,则反应中生成的氯气分子数小于 0.1NA,故C错误;
D.CH4和C2H4分子中均含有4个H原子,则标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为:![]() ×4×NA=2NA,故D正确;
×4×NA=2NA,故D正确;
故答案为D。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】氯吡格雷是一种用于抑制血小板聚集的药物,根据原料的不同,该药物的合成路线通常有两条,其中以2—氯苯甲醛为原料的合成路线如下:

(1)D→E所需X物质的结构简式:____________。
(2)C→D反应生成D的产量偏低,请解释原因:______________________________________(3)写出C聚合成高分子化合物的方程式___________________________________;
(4)A能转化成F分子C7H7NO2,写出同时符合下列条件F的所有同分异构体的结构简式:__________。
①红光光谱表明分子中含有-COO-结构;
②1H-NMR谱显示分子中含有苯环,且苯环上有三种不同化学环境的氢原子。
(5)已知:![]()
写出由乙烯、甲醇为有机原料制备化合物![]() 的合成路线流程图_____________________(无机试剂任选)。合成路线流程图示例如下:
的合成路线流程图_____________________(无机试剂任选)。合成路线流程图示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,浓度都是1 mol·L-1的两种气体X2和Y2,在密闭容器中反应生成气体Z。反应2 min后,测得参加反应的X2为0.6 mol·L-1,用Y2的变化表示的反应速率v(Y2)=0.1 mol·L-1· min-1,生成的c(Z)为0.4 mol·L-1,则该反应的化学方程式是( )
A.X2+2Y2![]() 2XY2B.3X2+Y2
2XY2B.3X2+Y2![]() 2X3Y
2X3Y
C.X2+3Y2![]() 2XY3D.2X2+Y2
2XY3D.2X2+Y2![]() 2X2Y
2X2Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,下列说法正确的是
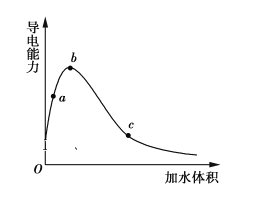
A.a、b、c三点溶液的pH:c<a<b
B.用湿润的pH试纸测量a处溶液的pH,测量结果偏小
C.a、b、c三点CH3COOH的电离程度:c<a<b
D.a、b、c三点溶液用1 mol·L1 NaOH溶液中和,消耗NaOH溶液体积:c<a<b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温时空气中的N2和O2会反应生成NO而污染大气:N2(g)+O2(g)=2NO(g)。试通过计算说明在1 200 ℃的条件下,此反应能否正向自发进行?估算自发进行的最低温度是多少______?[已知该反应:ΔH=+180.50 kJ·mol-1,ΔS=247.7 J·mol-1·K-1]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示的原电池,下列说法正确的是( )。

A.锌是电池负极,发生还原反应
B.电子从铜电极通过电流计流向锌电极
C.盐桥中的阳离子向硫酸铜溶液中迁移
D.实验过程中取出盐桥,原电池仍继续工作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氨水中存在电离平衡:NH3·H2O ![]() NH4+ + OH-,下列情况能引起电离平衡向右移动的有( )。
NH4+ + OH-,下列情况能引起电离平衡向右移动的有( )。
①加NH4Cl固体 ②加NaOH溶液 ③通HCl ④加CH3COOH溶液 ⑤加水
A.①③⑤B.①④⑤C.①②④D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了三位为锂离子电池发展做出巨大贡献的科学家,锂离子电池广泛应用于手机、笔记本电脑等。
(1)锂元素在元素周期表中的位置:_________________。
(2)氧化锂(Li2O)是制备锂离子电池的重要原料,氧化锂的电子式为_____________。
(3)近日华为宣布:利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出了石墨烯电池,电池反应式为LIxC6+Li1-x![]() C6+LiCoO2,其工作原理如图。
C6+LiCoO2,其工作原理如图。

①石墨烯的优点是提高电池的能量密度,石墨烯为层状结构,层与层之间存在的作用力是_______。
②锂离子电池不能用水溶液做离子导体的原因是___________(用离子方程式表示)。
③锂离子电池放电时正极的电极反应式为________________。
④请指出使用锂离子电池的注意问题____________________。(回答一条即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将含有0.4 mol CuSO4和0.1 mol NaCl的水溶液用惰性电极电解一段时间后,若在一个电极上得到6.4g Cu,则另一电极上生成气体(在标准状况)的体积为
A.1.12 LB.1.68 LC.2.24 LD.3.36L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com