
【题目】能源是人类赖以生存的基础。回答下列问题:
(1)下列不属于新能源的是________(填字母)。
a.煤炭 b.太阳能 c.风能 d.地热能
(2)已知:
Ⅰ.H2(g)+![]() O2(g)=H2O(g) H1=-241.8kJmol-1
O2(g)=H2O(g) H1=-241.8kJmol-1
Ⅱ.H2(g)+![]() O2(g)=H2O(l) H2=-285.8kJmol-1
O2(g)=H2O(l) H2=-285.8kJmol-1
气态分子中的化学键 | 断开1 mol化学键所需的能量/kJ |
O-H | 465 |
O=O | 498 |
①氢气的燃烧热为________kJmol-1.
②断开1 mol H-H键需要吸收的能量为________kJ。
③36 g H2O(1)完全分解生成氧气和氧气,需要吸收________kJ的能量。
(3)金刚石和石墨为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时完全燃烧生成二氧化碳,反应中放出的热量如图所示。
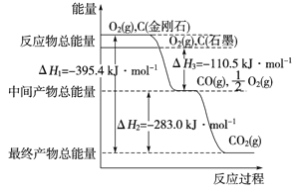
①在通常状况下,金刚石和石墨的稳定性较大的是________ (填“金刚石”或“石墨”)。
②12 g石墨在一定量空气中燃烧,生成36g气体,该过程放出的热量为________kJ。
【答案】a 285.8 439.2 571.6 石墨 252.0
【解析】
(1)太阳能、风能、地热能、氢能均为新能源;
(2)①燃烧热是1mol可燃物完全燃烧产生稳定的氧化物时放出的热量,H2O的稳定状态是液态;
②根据反应热等于断裂反应物化学键吸收的能量与形成生成物化学键释放的能量差计算H-H键的键能;
③根据II可知1mol液态水分解产生氧气和氢气,吸收285.8kJ的能量,结合物质变化与能量变化成正比计算2mol水反应吸收的能量。
(3)①物质含有的能量越低,物质的稳定性越强。由图可知石墨能量低,石墨更稳定;
②12g石墨在一定量空气中燃烧,生成气体36g,生成的气体为一氧化碳和二氧化碳的混合气体,物质的量与热量成正比,结合图象计算。
(1)太阳能、风能、地热能、氢能均为新能源,而煤炭、天然气、石油则为化石能源,故不属于新能源的是a;
(2)①氢气的燃烧热是1molH2完全燃烧产生1mol液态水时放出的热量,根据已知信息可知氢气的燃烧热是285.8kJ/mol;
②由于反应热等于断裂反应物化学键吸收的能量与形成生成物化学键释放的能量差,所以H-H+![]() ×498kJ-2×465kJ=-241.8kJ,解得H-H=439.2kJ;
×498kJ-2×465kJ=-241.8kJ,解得H-H=439.2kJ;
③根据Ⅱ可知1molH2反应产生1mol液态H2O放出热量285.8kJ,则1mol液态H2O分解产生氢气和氧气吸收285.8kJ的热量,则2mol液态H2O分解产生氢气和氧气吸收热量为2×285.8kJ=571.6kJ。
(3)①由图可知,金刚石能量高于石墨,物质含有的能量越低越稳定,说明石墨比金刚石稳定;
②12g石墨物质的量为1mol,在一定量空气中燃烧,依据元素守恒,若完全生成CO2气体质量为44g,若完全生成CO气体质量为28g,现在生成气体质量是36g,28g<36g<44g,可知生成的气体为CO和CO2混合气体,设CO物质的量为x,CO2物质的量为(1-x)mol,28x+44(1-x)=36g,解得x=0.5mol,CO2物质的量为0.5mol,结合图象可知C(石墨,s)+O2(g)=CO2(g) △H=-393.5 kJ/mol,使C(石墨,s)+![]() O2(g)=CO(g) △H=-110.5 kJ/mol,生成CO2和CO混合气体放出热量Q=393.5kJ/mol×0.5mol+110.5kJ/mol×0.5mol=252.0kJ;12g石墨在一定量空气中燃烧,生成气体36g,该过程放出的热量为252.0kJ。
O2(g)=CO(g) △H=-110.5 kJ/mol,生成CO2和CO混合气体放出热量Q=393.5kJ/mol×0.5mol+110.5kJ/mol×0.5mol=252.0kJ;12g石墨在一定量空气中燃烧,生成气体36g,该过程放出的热量为252.0kJ。


科目:高中化学 来源: 题型:
【题目】关于如图所示的原电池,下列说法正确的是( )。

A.锌是电池负极,发生还原反应
B.电子从铜电极通过电流计流向锌电极
C.盐桥中的阳离子向硫酸铜溶液中迁移
D.实验过程中取出盐桥,原电池仍继续工作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电解法可提纯含有某些含氧酸根杂质的粗KOH溶液,其工作原理如图所示。下列有关说法错误的是
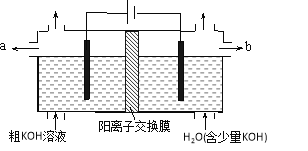
A. 通电后阴极区附近溶液pH会增大
B. 阳极反应式为4OH--4e-=2H2O+O2↑
C. 纯净的KOH溶液从b出口导出
D. K+通过交换膜从阴极区移向阳极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1 L密闭容器中,发生反应N2(g)+3H2(g)![]() 2NH3(g),若最初加入的N2和H2物质的量均为4 mol,测得10s内H2的平均速率v(H2)=0.12 molL-1s-1,则反应进行到10s时容器中N2的物质的量是
2NH3(g),若最初加入的N2和H2物质的量均为4 mol,测得10s内H2的平均速率v(H2)=0.12 molL-1s-1,则反应进行到10s时容器中N2的物质的量是
A.1.6molB.2.8molC.3.2molD.3.6mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将含有0.4 mol CuSO4和0.1 mol NaCl的水溶液用惰性电极电解一段时间后,若在一个电极上得到6.4g Cu,则另一电极上生成气体(在标准状况)的体积为
A.1.12 LB.1.68 LC.2.24 LD.3.36L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应CCl4 +4Na![]() C(金刚石)+4NaCl可实现人工合成金刚石。下列关于该反应的说法错误的是( )
C(金刚石)+4NaCl可实现人工合成金刚石。下列关于该反应的说法错误的是( )
A.C(金刚石)属于原子晶体
B.该反应利用了Na的强还原性
C.CCl4和C(金刚石)中的C的杂化方式相同
D.NaCl晶体中每个Cl-周围有8个Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。马蒂逊(Mathieson)法制备亚氯酸钠的流程如下:
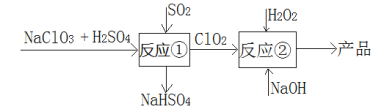
下列说法错误的是( )
A.反应①阶段,参加反应的NaClO3和SO2的物质的量之比为2:1
B.若反应①通过原电池来实现,则ClO2是正极产物
C.反应②中的H2O2可用NaClO4代替
D.反应②条件下,ClO2的氧化性大于H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酯类化合物与格氏试剂(RMgX,X=Cl、Br、I)的反应是合成叔醇类化合物的重要方法,可用于制备含氧多官能团化合物。化合物F合成路线如下,回答下列问题:
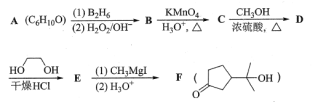
已知信息如下:
①RCH=CH2![]() RCH2CH2OH
RCH2CH2OH
②![]()
③RCOOCH3![]()
(1)A的结构简式为___,B→C的反应类型为__,C中官能团的名称为__,C→D的反应方程式为___。
(2)写出符合下列条件的D的同分异构体__(填结构简式,不考虑立体异构)。
①含有五元碳环结构;②能与NaHCO3溶液反应放出CO2;③能发生银镜反应。
(3)判断化合物F中有无手性碳原子,若有用“*”标出。__
(4)已知羟基能与格氏试剂发生反应。写出以![]() 、CH3OH和格氏试剂为原料制备
、CH3OH和格氏试剂为原料制备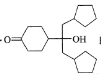 的合成路线(其它试剂任选)。__
的合成路线(其它试剂任选)。__
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图两个实验装置是实现化学能和电能相互转化的装置。
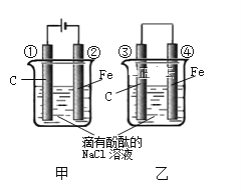
(1)把电能转化为化学能的装置是________(填“甲”或“乙”)
(2)铁电极腐蚀更严重的装置是_______(填“甲”或“乙”)
(3)②电极上的电极反应式为______________ ③电极上的电极反应式为________
(4)甲、乙两装置电极附近的溶液首先变红的电极是 ______
a.①② b②③ c③④ d①④
(5)写出装置甲反应的离子方程式 ________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com