
【题目】下图两个实验装置是实现化学能和电能相互转化的装置。
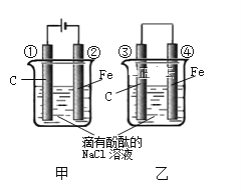
(1)把电能转化为化学能的装置是________(填“甲”或“乙”)
(2)铁电极腐蚀更严重的装置是_______(填“甲”或“乙”)
(3)②电极上的电极反应式为______________ ③电极上的电极反应式为________
(4)甲、乙两装置电极附近的溶液首先变红的电极是 ______
a.①② b②③ c③④ d①④
(5)写出装置甲反应的离子方程式 ________
【答案】甲 乙 2H++2e-=H2 ↑ O2+2H2O+4e-=4OH- B 2 Cl- + 2H2O ![]() 2OH- + H2↑+ Cl2↑
2OH- + H2↑+ Cl2↑
【解析】
根据原电池及电解池的原理及装置特点分析判断;根据吸氧腐蚀原理分析书写电极反应式;根据电解池原理及反应物书写装置中的电解方程式。
(1)甲装置中有直流电源,属于电解池,能将电能转化为化学能;没有外接电源且能自发进行氧化还原反应的装置为原电池,原电池将化学能转化为电能,乙装置能自发进行氧化还原反应,符合原电池条件,所以乙属于原电池;故答案为:甲;
(2)甲装置中铁电极作为阴极,不易被腐蚀,乙装置中铁作为负极,发生氧化反应,所以腐蚀比较严重,故答案为:乙;
(3)②电极为电解池的阴极,得电子发生还原反应,电极反应为2H++2e-=H2 ↑;③电极为原电池的正极,氧气得电子发生还原反应,属于吸氧腐蚀,电极反应为O2+2H2O+4e-=4OH-,故答案为:2H++2e-=H2 ↑ ;O2+2H2O+4e-=4OH-;
(4)甲装置中,阴极上氢离子放电,同时电极附近生成氢氧根离子,乙装置中碳电极上氧气得电子和水反应生成氢氧根离子,酚酞试液遇碱变红色,所以甲、乙两装置电极附近的溶液首先变红的电极分别是②、③,故答案为:B;
(5)甲装置中,阳极上氯离子放电,阴极上氢离子放电生成氢气,所以电池反应式为2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑,离子方程式为:2Cl- + 2H2O
2NaOH+Cl2↑+H2↑,离子方程式为:2Cl- + 2H2O ![]() 2OH- + H2↑+ Cl2↑,故答案为:2Cl- + 2H2O
2OH- + H2↑+ Cl2↑,故答案为:2Cl- + 2H2O ![]() 2OH- + H2↑+ Cl2↑。
2OH- + H2↑+ Cl2↑。


 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案科目:高中化学 来源: 题型:
【题目】能源是人类赖以生存的基础。回答下列问题:
(1)下列不属于新能源的是________(填字母)。
a.煤炭 b.太阳能 c.风能 d.地热能
(2)已知:
Ⅰ.H2(g)+![]() O2(g)=H2O(g) H1=-241.8kJmol-1
O2(g)=H2O(g) H1=-241.8kJmol-1
Ⅱ.H2(g)+![]() O2(g)=H2O(l) H2=-285.8kJmol-1
O2(g)=H2O(l) H2=-285.8kJmol-1
气态分子中的化学键 | 断开1 mol化学键所需的能量/kJ |
O-H | 465 |
O=O | 498 |
①氢气的燃烧热为________kJmol-1.
②断开1 mol H-H键需要吸收的能量为________kJ。
③36 g H2O(1)完全分解生成氧气和氧气,需要吸收________kJ的能量。
(3)金刚石和石墨为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时完全燃烧生成二氧化碳,反应中放出的热量如图所示。
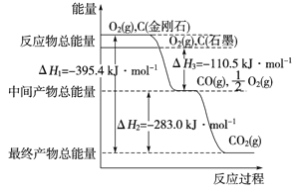
①在通常状况下,金刚石和石墨的稳定性较大的是________ (填“金刚石”或“石墨”)。
②12 g石墨在一定量空气中燃烧,生成36g气体,该过程放出的热量为________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有下列六种物质的溶液:①氨水②NH4Cl③NaHSO4④醋酸⑤CH3COONa⑥NaHCO3。
①溶液呈酸性的是_______________(将相应的序号填入空格,下同)。
②溶液呈碱性的是______________。
③能促进水电离的是______________。
④能抑制水电离的是______________。
(2)FeCl3水解的离子方程式为___________________。改变下列条件:①升高温度②加入少量浓盐酸③加水稀释④加少量铁粉⑤加少量NaHCO3(s)。
①使水解平衡右移的是___________。
②使水解平衡左移的是___________。
③使溶液pH减小的是_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结晶玫瑰是具有玫瑰香气的香料,可由下列方法合成(部分反应物及反应条件未标出)

已知: ![]() (-R表示烃基)
(-R表示烃基)
(1)A是苯的一种同系物,相同条件下,其蒸气对氢气的相对密度是46,则A的名称是__________。
(2)反应②所需药品及反应条件是_________________。
(3)C的核磁共振氢谱峰面积之比是_________。
(4)C有多种同分异构体,其中属于芳香族化合物的有________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把Ca(OH)2放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s) ![]() Ca2+(aq)+2OH-(aq)。下列说法正确的是( )
Ca2+(aq)+2OH-(aq)。下列说法正确的是( )
A.恒温下向溶液中加入CaO,溶液的pH升高
B.给溶液加热,溶液的pH升高
C.向溶液中加入Na2CO3溶液,其中固体质量增加
D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数用![]() 表示,下列叙述正确的是
表示,下列叙述正确的是![]()
①![]() 含有电子数为
含有电子数为![]()
②![]() 中含有的
中含有的![]() 键总数目为
键总数目为![]()
③![]()
![]() 与
与![]() 完全反应时转移电子数为
完全反应时转移电子数为![]()
④![]() 硅晶体中含有
硅晶体中含有![]() 个
个![]() 键
键
⑤![]() 通入足量氢氧化钠溶液中充分反应,转移的电子数等于
通入足量氢氧化钠溶液中充分反应,转移的电子数等于![]()
⑥![]() ,
,![]()
![]() 溶液中,
溶液中,![]() 和
和![]() 离子数的总和是
离子数的总和是![]()
⑦在常温常压下,![]() 铁与
铁与![]()
![]() 充分反应,转移的电子数为
充分反应,转移的电子数为![]()
⑧![]() 和
和![]() 的混合物共
的混合物共![]() ,其中所含原子数一定为
,其中所含原子数一定为![]() .
.
A.①②③⑤⑧B.②④⑥⑦⑧C.①③⑤⑥⑦D.①②④⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2与ICl的反应分①、②两步进行,其能量曲线如图所示,下列有关说法错误的是

A. 反应①、反应②均为放热反应
B. 反应①、反应②均为氧化还原反应
C. 反应①比反应②的速率慢,与相应正反应的活化能无关
D. 反应①、反应②的焓变之和为ΔH=-218kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据要求填空。
(1)在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:
①当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是________。
②同体积、同PH的三种酸,中和NaOH的能力由大到小的顺序是________。
③将PH相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是________。
(2)已知:Ksp(AgBr)=7.7×10-13,Ksp(AgSCN)=1×10-12;AgBr(s)+SCN-(aq)![]() AgSCN(s)+Br-(aq)的平衡常数____________。
AgSCN(s)+Br-(aq)的平衡常数____________。
(3)已知NH4A溶液为中性,又知将HA溶液加入Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH________7(填“<”、“>”或“=”);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序是________________(填序号)。
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
(4)在室温下,有下列四种溶液:①NH4Cl②CH3COONH4③NH4HSO4④NH3·H2O,若c(NH4+)相等,则四种溶液的浓度由大到小的排列顺序是__________(填序号)。
(5)某二元弱酸H2A,已知:Ka1=1.54×10-2,Ka2=1.02×10-7;NaHA溶液显________性,原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中的各组元素![]() 从左到右
从左到右![]() 同时满足下列三个条件的是 ( )
同时满足下列三个条件的是 ( )
a.原子半径依次减小;b.第一电离能逐渐升高;c.电负性逐渐增大。
A.Na、Mg、AlB.C、O、N C. Li、Na、KD.I、Cl、F
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com