
在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略)。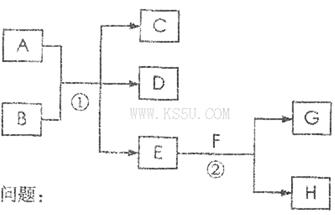
回答下列问题:
(1)在反应②中,每生成2.24L气体G(标准状况)时,该反应转移电子的物质的量是___________mol。
(2)若反应①在加热条件下进行,单质A和化合物B按物质的量之比为1:2发生反应,且C、D是两种均能使澄清的石灰水变浑浊的无色气体,则反应①的化学方程式是___________________________________________。
(3)若反应①在溶液中进行,A是一元强碱,B是一种酸式盐,D是一种使湿润红色石蕊试纸变蓝的气体,且B遇盐酸能生成使品红溶液褪色的气体。在加热条件下,当A过量时,反应①的离子方程式是_________________________________________。
(1)0.2 molL(1分)
(2)2H2SO4(浓)+C 2SO2↑+CO2↑+2H2O(2分)
2SO2↑+CO2↑+2H2O(2分)
(3)HSO3-+NH4++2OH-=NH3↑+SO32-+2H2O(2分)
解析试题分析:由题中信息“E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体”,可知E为水,F为过氧化钠,G为氧气。2Na2O2+2H2O=4NaOH+O2↑. 每生成2.24L气体G(标准状况)时,转移的电子是2 mol. (2)图中反应①的信息知道,单质A是C和化合物B是浓硫酸,二者反应生成CO2和SO2,化学方程式2H2SO4(浓)+C 2SO2↑+CO2↑+2H2O; (3)图中信息:A是一元强碱,B是一种酸式盐,D是一种使湿润红色石蕊试纸变蓝的气体,且B遇盐酸能生成使品红溶液褪色的气体。A是NaOH,B是NH4HSO3.碱过量时 ①的离子方程式是HSO3-+NH4++2OH-=NH3↑+SO32-+2H2O
2SO2↑+CO2↑+2H2O; (3)图中信息:A是一元强碱,B是一种酸式盐,D是一种使湿润红色石蕊试纸变蓝的气体,且B遇盐酸能生成使品红溶液褪色的气体。A是NaOH,B是NH4HSO3.碱过量时 ①的离子方程式是HSO3-+NH4++2OH-=NH3↑+SO32-+2H2O
考点:框图推断题目,根据信息推断物质并书写方程式。铵盐和浓硫酸及SO2性质的考查。


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:填空题
下列框图所示的物质转化关系中,甲是日常生活中常见的金属,乙、丙、丁是常见的气体单质。气体B与气体C相遇产生大量的白烟生成E,A是强碱,D的焰色为紫色 (部分反应物和生成物及水已略去)。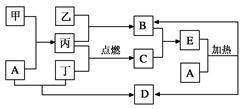
请回答下列问题
(1)写出工业制备B的化学方程式_____________________________________;
(2)写出常温下,A与丁反应的离子方程式________________________________;
(3)下图装置为用排空气法收集气体的实验装置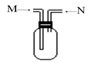
Ⅰ.当从M端通入气体时,可收集的气体有 ;
Ⅱ.当从N端通入气体时,可收集的气体有 ; (填数字编号)
①气体乙 ②气体丙 ③气体丁 ④气体B ⑤气体C
(4)E中所含阳离子的检验方法为(包括实验步骤、现象及结论) ;
(5)A中所含阳离子的检验方法为(包括实验步骤、现象及结论) 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分)
Ⅰ.短周期元素组成的单质X2、Y,标准状况下X2的密度为3.17g·L-1;常温下,Y为浅黄色固体。Z是一种化合物,焰色反应呈浅紫色(透过钴玻璃);0.1mol·L-1 Z的水溶液pH=13。X2、Y 和Z之间有如下转化关系(其他无关物质已略去)
 (1)写出常温下单质X2与Z反应的离子方程式
(1)写出常温下单质X2与Z反应的离子方程式
(2)已知C能与硫酸反应生成能使品红溶液褪色的气体
①D的化学式是 ;D的水溶液pH>7,原因是(用离子方程式表示)
②将20mL 0.5mol·L-1 C溶液逐滴加入到20 mL 0.2mol·L-1 KMnO4溶液(硫酸酸化)中,溶液恰好褪为无色。写出反应的离子方程式
Ⅱ.下表是元素周期表的一部分,表中所列的字母分别代表某一元素.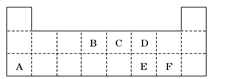
某种金属元素的单质G,可以发生如下图所示转化:
其中化合物M是一种白色胶状沉淀;K的溶液与过量B的某种氧化物反应的化学方程式为___________________________;一种新型无机非金属材料由G元素和C元素组成,其化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系: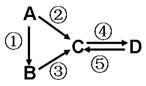
(1)若A是淡黄色固体,C、D是氧化物,且C是造成酸雨的主要物质。写出其中D与水反应生成的酸名称 。
(2)若B是气态氢化物。C、D是氧化物且会造成光化学烟雾污染。写③反应的化学方程式 。
(3)若D物质具有两性, ② ③ 反应均要用强碱溶液,④ 反应是通入过量的一种引起温室效应的主要气体。写④ 反应离子方程式 。
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性。写出② 反应的化学方程式 。
(5)若A是应用最广泛的金属。④ 反应用到A,② ⑤ 反应均用到同一种非金属单质。C的溶液用于蚀刻印刷铜电路板,写该反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图所示,已知: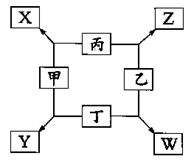
①甲、乙、丙、丁均为前三周期元素的单质,甲、乙、 丙常温下为气体。
②在一定条件下甲与丙和甲与丁都按物质量之比l:3反应,分别生成X和Y,在产物中元素甲呈负价。
③在一定条件下乙与丙和乙与丁都按物质的量之比1:2反应,分别生成Z和W,在产物中元素乙呈负价。
请填空:
(1)W的电子式为 ;
(2)X与乙催化氧化的化学方程式是______________________________________________;
(3)Y与Z反应的化学方程式是_____________________________________________;
(4)2.4g丁与足量的乙反应生成W放出QkJ的热,则该反应的热化学方程式为 ;
(5)实验室制取丙的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、J是日常生活中常见的两种金属,这两种金属和NaOH组成原电池,A作负极;F常温下是气体单质,各物质有以下的转化关系(部分产物及条件略去)。Ks5u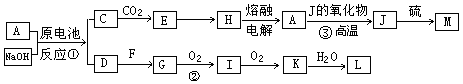
请回答以下问题:
(1)写出该原电池的总反应方程式_____________________。
(2)写出②的化学方程_________________。
(3)常温时pH=12的C溶液中,溶质的阳离子与溶质的阴离子浓度之差为 。(写出计算式)
(4)若③中J的氧化物为磁性氧化物,且每生成1mol J放出Q kJ的热量,请写出A→J反应的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图中A~J均为中学化学中常见的物质,它们之间有如下转化关系。其中A、D为金属单质。(反应过程中生成的水及其他产物已略去)
请回答以下问题:
(1)B是_____________,H是_____________(填化学式)
(2)写出J与D反应转化为G的离子方程式_______________________________________
(3)A在常温下也可与NaOH溶液反应生成F,写出此反应的离子方程式 _____________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D均为中学化学常见物质,且含有一种相同的 元素,它们之间有如下转化关系,其中A是单质。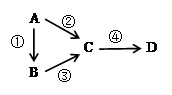
(1)若A是一种淡黄色固体,B是气态氢化物,C、D为气态氧化物,且C是形成酸雨的主要物质。请写出C与B反应的化学方程式_________________________________。
(2)若B是气态氢化物,C、D为气态氧化物,且C、D是形成光化学烟雾的一个重要原因。请写出反应③的化学方程式____________________________________。实验室中检验气体B存在用的试剂或用品为________________。
(3)若B、D既能溶于强酸溶液,又能溶于强碱溶液,反应②③均需要强碱性溶液,反应④可以通过滴加少量稀盐酸实现。据此判断A元素在周期表中的位置是_________________。请写出②的离子方程式___________________________________。
(4)若C是一种淡黄色固体,常用于吸吸面具中的供氧剂,D是一种强碱。写出反应④的离子方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
向溶液X中持续通入过量气体Y,会产生“先浑浊,后澄清”现象的是
| A.X:氯化钙溶液 Y:二氧化碳 |
| B.X:硝酸钡溶液 Y:二氧化硫 |
| C.X:氯化铝溶液 Y:氨气 |
| D.X:偏铝酸钠溶液 Y:二氧化氮 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com