
【题目】在一定温度下,10L密闭容器中加入5molSO2、4molO2 , 经10min后反应达平衡时有3molSO2发生了反应.试计算:
(1)用SO2表示该反应的反应速率为多少 .
(2)平衡时O2的转化率为 .
(3)平衡时O2在反应混合气中的物质的量分数 .
(4)平衡常数K值为 .
【答案】
(1)0.03mol/(L.min)
(2)37.5%
(3)33.3%
(4)9
【解析】解:经10min后反应达平衡时有3molSO2发生了反应,则
2SO2+ | O2 | 2SO3 | |
开始 | 5 | 4 | 0 |
转化 | 3 | 1.5 | 3 |
平衡 | 2 | 2.5 | 3 |
1)用SO2表示该反应的反应速率为 ![]() =0.03mol/(L.min),所以答案是:0.03mol/(L.min);(2)平衡时O2的转化率为
=0.03mol/(L.min),所以答案是:0.03mol/(L.min);(2)平衡时O2的转化率为 ![]() ×100%=37.5%,所以答案是:37.5%;(3)平衡时O2在反应混合气中的物质的量分数为
×100%=37.5%,所以答案是:37.5%;(3)平衡时O2在反应混合气中的物质的量分数为 ![]() ×100%=33.3%,所以答案是:33.3%;(4)平衡常数K=
×100%=33.3%,所以答案是:33.3%;(4)平衡常数K= ![]() =9,所以答案是:9.
=9,所以答案是:9.
【考点精析】通过灵活运用化学平衡的计算,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%即可以解答此题.


科目:高中化学 来源: 题型:
【题目】取100 mL的Na2CO3和Na2SO4混合溶液,加入适量Ba(OH)2溶液100 mL后,恰好完全反应,过滤、干燥后得到14.51 g白色沉淀和滤液,再用过量稀硝酸处理沉淀,最后减少到4.66 g,并有气体放出.计算:
(1)原混合液中Na2SO4的物质的量浓度为________mol·L-1;
(2)产生的气体在标准状况下的体积为________L;
(3)过滤出沉淀后,计算所得滤液的物质的量浓度(设反应前后溶液的密度均为1 g·cm-3,反应前后溶液体积变化忽略不计)___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取25.0gCuSO45H2O晶体,加热使之均匀、缓慢升温至1000℃并恒温1小时,试通过计算回答下列问题(如果是混合物,要算出混合物中各组分的质量):
(1)在某中间温度时,固体产物质量是否可能为10g?
(2)不考虑实验带来的误差,在反应条件下,反应气态产物除去水后,物质的量可能为
A.0mol
B.0.1mol
C.大于0.1mol
(3)你认为最终固体产物为多少克?产物颜色如何?
(4)如果某同学做此实验时最后固体质量为7.6g,试计算其组分.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在杠杆的两端分别挂着质量相同的铝球和铁球,此时杠杆平衡。然后将两球分别浸没在溶液质量相等的稀烧碱溶液和硫酸铜溶液中一段时间,如图所示。下列说法正确的是
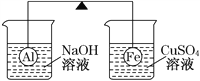
A. 铝球表面有气泡产生,溶液澄清;铁球表面有红色物质析出,溶液蓝色变浅,杠杆右边下沉
B. 铝球表面有气泡产生,且有白色沉淀生成,杠杆不平衡
C. 反应后去掉两烧杯,杠杆仍平衡
D. 右边球上出现红色,左边溶液的c(OH-)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出元素在周期表中的位置,离子结构示意图以及粒子半径大小比较
(1)Al元素在周期表中的位置;S元素在周期表中的位置 .
(2)S2﹣电子式
(3)粒子半径比较:Mg2+O2﹣ , Mg2+Ca2+ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石英(SiO2)系列光纤,具有低耗、宽带的特点,已广泛应用于有线电视和通信系统。SiO2属于( )
A. 氧化物 B. 酸 C. 碱 D. 盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中,HCl作还原剂的是( )
A. NaOH + HCl = NaCl + H2O
B. Zn + 2HCl = ZnCl2 + H2↑
C. MnO2 + 4HCl(浓)![]() MnCl2 + 2H2O + Cl2↑
MnCl2 + 2H2O + Cl2↑
D. CuO + 2HCl = CuCl2 + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在5L Na2SO4溶液中含有Na+离子4.6g,则溶液中SO42-离子的物质的量浓度为( )
A. 0.2mol·L-1 B. 0.04 mol·L-1 C. 0.08 mol·L-1 D. 0.02mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com