
����Ŀ���ڸܸ˵����˷ֱ����������ͬ�����������ʱ�ܸ�ƽ�⡣Ȼ������ֱ��û����Һ������ȵ�ϡ�ռ���Һ������ͭ��Һ��һ��ʱ�䣬��ͼ��ʾ������˵����ȷ����
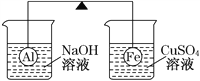
A. ������������ݲ�������Һ���壻��������к�ɫ������������Һ��ɫ��dz���ܸ��ұ��³�
B. ������������ݲ��������а�ɫ�������ɣ��ܸ˲�ƽ��
C. ��Ӧ��ȥ�����ձ����ܸ���ƽ��
D. �ұ����ϳ��ֺ�ɫ�������Һ��c(OH��)����
���𰸡�A
��������A. ���ձ��з���2Al+2NaOH+2H2O=2NaAlO2+3H2�������ձ��з���Fe+CuSO4=Cu+FeSO4���۲쵽������������ݲ�������Һ���壬����������к�ɫ������������Һ��ɫ��dz���ɷ�Ӧ��֪���ձ���Al��������С�����ձ���Fe��������Cu������ܸ��ұ��³�����A��ȷ��B. ���ձ��з���2Al+2NaOH+2H2O=2NaAlO2+3H2���������ɳ�������B����C. ��A��ķ�����֪����Ӧ��ȥ�����ձ����ܸ˲���ƽ�⣬��C����D. �ұ���������Cu������ֺ�ɫ���������Һ������NaOH����c(OH)��С����D����ѡA��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��CH4��g��+2O2��g���TCO2��g��+2H2O��l����H1=��Q1 kJmol��1 2H2��g��+O2��g���T2H2O��g������=��Q2 kJmol��1 ��
2H2��g��+O2��g���T2H2O��l������H2=��Q3 kJmol��1
�����£�ȡ�����2��3�ļ���������Ļ������11.2L����״���£�������ȫȼ�պ�ָ������£���ų�������Ϊ�� ��
A.0.4Q1+0.15Q2
B.0.2Q1+0.05Q2
C.0.2Q1+0.15Q3
D.0.2Q1+0.3Q2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������з�Ӧ:
�١�2H2O+Cl2+SO2��H2SO4+2HCl
�ڡ� KMnO4+ HCl(Ũ)�� KCl+__MnCl2+___Cl2��+___H2O
�������������Ӧ�ش�
��1����ƽ�ڵĻ�ѧ����ʽ________��
��2���õ����ű�����е���ת�Ƶķ������Ŀ________��
��3��Cl2��SO2��KMnO4��������ǿ��˳��Ϊ____��
��4����Ӧ������������ͻ�ԭ��������ʵ���֮��Ϊ___��
��5����Ӧ�����Ȼ�����ֳ���������___��
A����ԭ�� B������ C��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£����ݻ�������ܱ������ڽ��з�Ӧ��2NO+2CON2+2CO2 ��H��0������a��ʾNO��ת�����뷴Ӧʱ��Ĺ�ϵ�����ı��ʼ������ʹ��Ӧ���̰�������b���У��ɲ�ȡ�Ĵ�ʩ�ǣ� �� 
A.�Ӵ���
B.�����¶�
C.����NO��Ũ��
D.���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾij��ѧ��Ӧ�����У������������ʱ��Ĺ�ϵ��ͼ��a��b��c�������߲��ܷ�ӳ�����������ض������������Ӱ��(����)

A. ��ͬ���¶� B. ��ͬ��pHֵ
C. ��ͬ�ĵ���Ũ�� D. ��ͬ��øŨ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȡһ�����飬���õ���ѷ����ǣ� ��
A.���������ȡ����Ӧ
B.��ϩ�������ӳɷ�Ӧ
C.��ϩ��HCl�ӳɷ�Ӧ
D.�����HCl����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£�10L�ܱ������м���5molSO2��4molO2 �� ��10min��Ӧ��ƽ��ʱ��3molSO2�����˷�Ӧ���Լ��㣺
��1����SO2��ʾ�÷�Ӧ�ķ�Ӧ����Ϊ���� ��
��2��ƽ��ʱO2��ת����Ϊ ��
��3��ƽ��ʱO2�ڷ�Ӧ������е����ʵ������� ��
��4��ƽ�ⳣ��KֵΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵�����ʾ������ȷ���ǣ� ��
A.�����ʵ������������������ֱ���ȫȼ�գ����߷ų���������
B.��ϡ��Һ�У�H+��aq��+OH����aq��=H2O��l����H=��57.3kJ/mol��������0.5molH2SO4��Ũ�����뺬1molNaOH����Һ��ϣ��ų����ȴ���57.3kJ
C.��C��s��ʯī��=C��s�����ʯ����H=+1.90kJ/mol��֪��ʯīû�н��ʯ�ȶ�
D.��101kPaʱ��2g��������ȫȼ������Һ̬ˮ���ų�285.8 kJ����������ȼ�յ��Ȼ�ѧ����ʽ��ʾΪ��2H2��g��+O2��g��=2H2O��l����H=��285.8kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ۺ����ü������ڽ�Լ��Դ���������ڱ���������ʵ�������÷Ͼɻ�ͭ��Cu��Zn�Ͻ𣬺���������Fe���Ʊ��������壨CuSO45H2O����������ZnO���Ʊ�����ͼ���£� 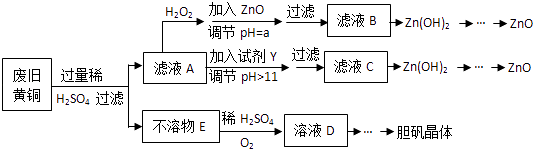
��֪��Zn���������������Al����������������ƣ�pH��11ʱZn��OH��2������NaOH��Һ����[Zn��OH��4]2���±��г��˼������������������������pH����ʼ������pH����������Ũ��Ϊ1.0molL��1���㣩��
Fe3+ | Fe2+ | Zn2+ | |
��ʼ������pH | 1.1 | 5.8 | 5.9 |
������ȫ��pH | 3.0 | 8.8 | 8.9 |
��ش��������⣺
��1������ZnO����pH=a��Ŀ���� �� a�ķ�Χ�� ��
��2���ɲ�����E������ҺD�Ļ�ѧ����ʽΪ ��
��3����ҺA�м���H2O2��Ӧ�����ӷ���ʽΪ ��
��4������ҺD�Ƶ��������������Ҫ���������� ��
��5�������Լ�����ΪY�Լ����� �� A��ZnO B��NaOH C��Na2CO3D��ZnSO4
������ҺC����μ�������ֱ��������������������� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com