
. 已知25℃、101 kPa下,金刚石、石墨燃烧的热化学方程式分别为:
C(石墨,s)+O2(g)=== CO2(g) △H=-393.51 kJ?? mol-1
C(金刚石,s)+O2(g)=== CO2(g) △H=-395.41 kJ?? moL-1
据此判断,下列说法正确的是
A. 由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低
B. 由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低
C. 由石墨制备金刚石是吸热反应;金刚石比石墨稳定
D. 由石墨制备金刚石是放热反应;石墨比金刚石稳定
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
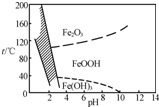 NiSO4?6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Zn、Fe、Cr等杂质)为原料获得.操作步骤如下:
NiSO4?6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Zn、Fe、Cr等杂质)为原料获得.操作步骤如下:| O | - 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
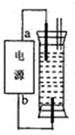 (2009?江门一模)某研究性学习小组设计了一个环保型消毒液发生器,如图所示装置,用一石墨作电极电解饱和NaCl溶液,请你完成以下实验探究过程:
(2009?江门一模)某研究性学习小组设计了一个环保型消毒液发生器,如图所示装置,用一石墨作电极电解饱和NaCl溶液,请你完成以下实验探究过程:
| ||
| ||
| 假设 | 实验操作 | 预期现象 | 结论 |
| ①有明显现象 | 用烧杯取少量消毒液,将一颗光亮的铁钉放入烧杯,浸泡一段时间 用烧杯取少量消毒液,将一颗光亮的铁钉放入烧杯,浸泡一段时间 |
铁定表面出现铁锈 铁定表面出现铁锈 |
铁定被锈蚀 铁定被锈蚀 |
| ②无明显现象,要进一步探究 | 用试管取少量(实验①)浸泡后的溶液,滴加足量的1mol/L的硫酸酸化,再用滴管滴加几滴20%的KSCN溶液 用试管取少量(实验①)浸泡后的溶液,滴加足量的1mol/L的硫酸酸化,再用滴管滴加几滴20%的KSCN溶液 |
溶液不变色或溶液显血红色 溶液不变色或溶液显血红色 |
铁钉可能未被腐蚀也可能被腐蚀 铁钉可能未被腐蚀也可能被腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com