
【题目】对于可逆反应 A(g)+3B(s)2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是( )
A.v(A)=0.5mol·L-1·min-1B.v(B)=1.0 mol·L-1·min-1
C.v(D)=0.4 mol·L-1·min-1D.v(C)=0.1 mol·L-1·s-1
科目:高中化学 来源: 题型:
【题目】最近,科学家用氮化鎵材料与铜组装如图所示的人工光合系统,实现了以CO2和H2O为原料制备CH4和O2下列有关说法中正确的是( )
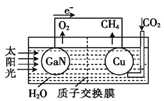
A. 该装置只有化学能转化为电能
B. 氮化镓电极是阴极
C. 导线中经过2mol的电子,氮化镓电极生成lmol O2
D. 铜电极表面的电极反应式:CO2+8e-+8H+=CH4+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用某分子筛作催化剂,NH3可脱除废气中的NO和NO2,生成两种无毒物质,其反应历程如图所示,下列说法正确的是( )
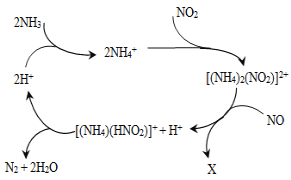
A.X是N2
B.NH![]() 中含有非极性共价键
中含有非极性共价键
C.NH3、NH![]() 、H2O中的质子数、电子数均相同
、H2O中的质子数、电子数均相同
D.上述历程的总反应为:2NH3+NO+NO2![]() 2N2+3H2O
2N2+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接乙醇燃料电池(DEFC) 具有无毒、来源丰富等优点,其装置如下图所示。装置工作时,下列说法错误的是
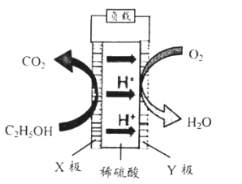
A.化学能转化为电能B.稀硫酸为该电池的电解质溶液
C.电子由Y极流出经负载流向X极D.电池反应为C2H5OH+ 3O2→2CO2+ 3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.化学反应的实质是旧键的断裂,新键的生成
B.CH4、CF4、CCl4、CBr4 熔、沸点逐渐升高,原因是分子间作用力逐渐增大
C.NH3 和 H2O 分子间都可以形成氢键
D.NH4H 是离子化合物,其含有离子键、极性键、非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代工业的发展导致CO2的大量排放,对环境造成的影响日益严重,通过各国科技工作者的努力,已经开发出许多将CO2回收利用的技术,其中催化转化法最具应用价值。回答下列问题:
(1)在催化转化法回收利用CO2的过程中,可能涉及以下化学反应:
①CO2(g)+2H2O(l)![]() CH3OH(l)+
CH3OH(l)+![]() O2(g) ΔH=+727kJ·mol-1 ΔG=+818kJ·mol-1
O2(g) ΔH=+727kJ·mol-1 ΔG=+818kJ·mol-1
②CO2(g)+3H2O(l)![]() CH4(g)+O2(g) ΔH=+890kJ·mol-1 ΔG=+818kJ·mol-1
CH4(g)+O2(g) ΔH=+890kJ·mol-1 ΔG=+818kJ·mol-1
③CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l) ΔH=-131kJ·mol-1 ΔG=-9.35kJ·mol-1
CH3OH(l)+H2O(l) ΔH=-131kJ·mol-1 ΔG=-9.35kJ·mol-1
④CO2(g)+4H2(g)![]() CH4(g)+2H2O(l) ΔH=-253kJ·mol-1 ΔG=-130kJ·mol-1
CH4(g)+2H2O(l) ΔH=-253kJ·mol-1 ΔG=-130kJ·mol-1
从化学平衡的角度来看,上述化学反应中反应进行程度最小的是__,反应进行程度最大的是__。
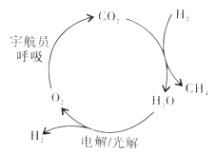
(2)反应CO2+4H2![]() CH4+2H2O称为Sabatier反应,可用于载人航空航天工业。我国化学工作者对该反应的催化剂及催化效率进行了深入的研究。
CH4+2H2O称为Sabatier反应,可用于载人航空航天工业。我国化学工作者对该反应的催化剂及催化效率进行了深入的研究。
①在载人航天器中利用Sabatier反应实现回收CO2,再生O2,其反应过程如图所示,这种方法再生O2的最大缺点是需要不断补充__(填化学式)。
②在1.5MPa,气体流速为20mL·min-1时研究温度对催化剂催化性能的影响,得到CO2的转化率(%)如下:
催化剂 | 180℃ | 200℃ | 220℃ | 280℃ | 300℃ | 320℃ | 340℃ | 360℃ |
Co4N/Al2O3 | 8.0 | 20.3 | 37.3 | 74.8 | 84.4 | 85.3 | 868 | 90.1 |
Co/Al2O3 | 0.2 | 0.7 | 2.0 | 22.4 | 37.6 | 48.8 | 54.9 | 59.8 |
分析上表数据可知:__(填化学式)的催化性能更好。
③调整气体流速,研究其对某催化剂催化效率的影响,得到CO2的转化率(%)如下:
气体流速/mL·min-1 | 180℃ | 200℃ | 220℃ | 280℃ | 300℃ | 320℃ | 340℃ | 360℃ |
10 | 11.0 | 25.1 | 49.5 | 90.2 | 93.6 | 97.2 | 98.0 | 98.0 |
30 | 4.9 | 11.2 | 28.9 | 68.7 | 72.7 | 79.8 | 82.1 | 84.2 |
40 | 0.2 | 5.2 | 15.3 | 61.2 | 66.2 | 71.2 | 76.6 | 79.0 |
50 | 0.2 | 5.0 | 10.0 | 50.0 | 59.5 | 61.2 | 64.1 | 69.1 |
分析上表数据可知:相同温度时,随着气体流速增加,CO2的转化率__(填“增大”或“减小”),其可能的原因是__。
④在上述实验条件中,Sabatier反应最可能达到化学平衡状态的温度是__,在1L恒容密闭容器中发生该反应,已知初始反应气体中V(H2):V(CO2)=4:1,估算该温度下的平衡常数为__(列出计算表达式)。
(3)通过改变催化剂可以改变CO2与H2反应催化转化的产物,如利用Co/C作为催化剂,反应后可以得到含有少量甲酸的甲醇。为了研究催化剂的稳定性,将Co/C催化剂循环使用,相同条件下,随着循环使用次数的增加,甲醇的产量如图所示,试推测甲醇产量变化的原因__。(已知Co的性质与Fe相似)
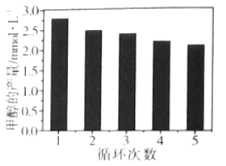
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四溴化钛(TiBr4)可用作橡胶工业中烯烃聚合反应的催化剂,常温下为橙黄色固体,熔点:38.3℃,沸点233.5℃,具有潮解性且易发生水解。实验室利用反应TiO2 +C+ 2Br2 ![]() TiBr4+CO2来制备TiBr4,装置如图所示。下列说法错误的是
TiBr4+CO2来制备TiBr4,装置如图所示。下列说法错误的是
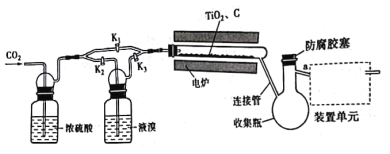
A.开始反应时,活塞的状态为K1关闭,K2,K3打开
B.为防止连接管堵塞,反应过程中需微热连接管
C.为达到实验目的,a应连接盛有NaOH溶液的洗气装置
D.反应结束后继续通入CO2排出装置中残留的四溴化钛及溴蒸气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)印刷电路板是由高分子材料和铜箔复合而成,可用FeCl3溶液作“腐蚀剂”刻制印刷电路,写出反应方程式______________________。
(2)工业上制取漂白粉的的过程是把氯气通入石灰乳中,写出反应方程__________________。
(3)有甲、乙、丙、丁四种金属,把甲、丙浸入稀硫酸中,用导线连接时甲为负极;把乙、丁分别浸入相同浓度的稀硫酸中,乙产生气泡的速率更大;把甲、乙用导线连接浸入稀硫酸中,甲上有气泡冒出;把丙浸入丁的硝酸盐溶液中,丙的表面有丁析出。这四种金属的活动性由强到弱的顺序是__________________。
(4)将气体A、B置于容积为2 L的密闭容器中,发生如下反应:4A(g)+B(g)=2C(g),反应进行到4 s末,测得A为0.5 mol,B为0.4 mol,C为0.2 mol,则:vA=_________,反应前A有_________mol。
(5)第三周期中有一种元素,其最高价氧化物的水化物与同周期其它元素最高价氧化物的水化物所属物质类型都不同,用离子方程式表示该水化物分别与烧碱溶液和稀硫酸的反应:______; __________。
(6)碳是周期表中形成化合物最多的元素,写出其单质与浓硫酸反应的方程式___________________写出能验证碳的非金属性弱于硫的化学反应的离子方程式:_____________________,碳还能形成各种有机物,它的一种有机物可由粮食发酵得到,有特殊的香味,有活血壮胆的功效,写出该有机物在某条件下与氧气催化氧化的反应方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】支撑海港码头基础的钢管柱,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是

A. 通入保护电流使钢管桩表面腐蚀电流接近于零
B. 通电后外电路电子被强制从高硅铸铁流向钢管桩
C. 高硅铸铁的作用是作为损耗阳极材料和传递电流
D. 通入的保护电流应该根据环境条件变化进行调整
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com